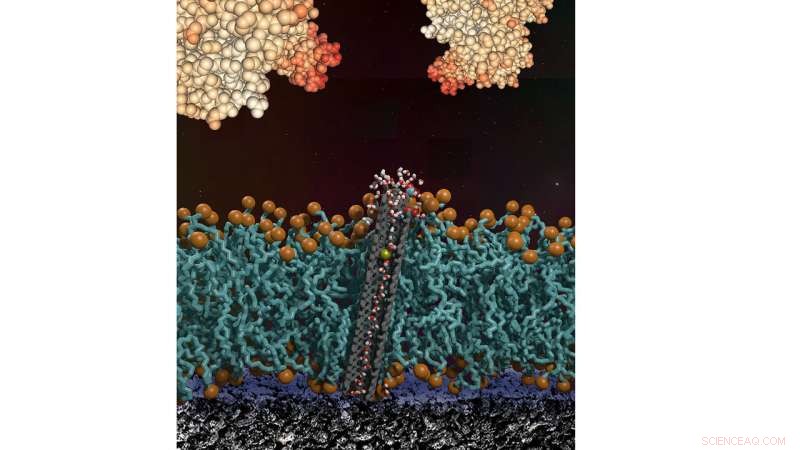
Uma seção transversal de uma bicamada lipídica com um poro de nanotubo de carbono na superfície de um dispositivo bioeletrônico. A bicamada protege a superfície de grandes incrustações de proteínas em solução e permite que a água, íons, e pequenas moléculas até a superfície do dispositivo. Crédito:Yuliang Zhang e Aleksandr Noy (LLNL)
Alguns biossensores e dispositivos médicos promissores funcionam bem em ambientes de laboratório imaculados. Contudo, eles tendem a parar de trabalhar para fornecer terapêuticas médicas ou monitorar problemas crônicos de saúde, uma vez expostos às condições do mundo real de fluidos biológicos complexos.
Uma espessa camada de incrustantes cobrirá rapidamente os biossensores, e não há uma boa maneira de reanimá-los depois que param de trabalhar. Essencialmente, um biossensor é tão bom quanto suas propriedades anti-incrustantes.
No Materiais APL , Aleksandr Noy e Xi Chen, do Laboratório Nacional Lawrence Livermore, reveja uma variedade de abordagens desenvolvidas para combater a incrustação. Essas abordagens abrangem barreiras físicas, tratamentos químicos, superfícies antiaderentes, e revestimentos seletivos semelhantes a membranas que formam "portas" para permitir que apenas certas espécies cheguem à superfície de trabalho do sensor.
"Existe todo um universo de abordagens muito inteligentes e eficazes para proteger biossensores de incrustações, "disse Noy." Os pesquisadores podem escolher a tecnologia que podem adaptar ao tipo específico de sensor que desejam projetar. "
Mas apesar de todo esse progresso, Noy e Chen apontam que a incrustação continua sendo um problema persistente que ainda pode destruir um bom biossensor.
"É necessário um maior desenvolvimento para aumentar nosso arsenal de métodos de proteção antivegetativos robustos, "Noy disse.
A incrustação ocorre em um processo de quatro estágios. Primeiro, as superfícies ficam imediatamente revestidas com uma pequena camada de moléculas. Segundo, esta camada fica coberta com a camada principal de foulant. Terceiro, a superfície suja começa a crescer biofilmes. Quarto, o biofilme progride para macrofouling, que geralmente ocorre dentro de dias ou semanas.
O objetivo é suprimir a ligação inicial de moléculas, porque é incrivelmente difícil remover biofilmes depois que eles se formam.
Um exemplo de proteção antivegetativa, baseado no próprio trabalho de Noy, é um sensor de pH com transistores de nanofio de silício que são protegidos por uma membrana fosfolipídica com poros de nanotubos de carbono embutidos na membrana.
"Os nanofios de silício são elegantes, pequena, e sensores de pH eficientes que fornecem sinal elétrico direto que é modulado pelo pH da solução, "disse ele." Infelizmente, sempre que entram em contato com um meio biológico real, eles se complicam e param de funcionar. "
Para contornar isso, sua abordagem cobre os sensores com uma membrana lipídica para fornecer uma barreira protetora de incrustação de proteína muito robusta.
"Para permitir que os prótons passem por esta barreira, nós embutimos minúsculos poros de nanotubos de carbono dentro da membrana, "Noy disse." Esses poros são o canal condutor de prótons mais eficaz conhecido, portanto, eles fornecem um conduíte ideal para transportar prótons através da barreira protetora. "
Sensores protegidos desta forma "podem suportar a exposição de três dias a soluções de proteína, leite, e até mesmo plasma sanguíneo e ainda medir o pH muito bem, " ele disse.