
Um polímero composto por uma proteína tubulina, é um componente do citoesqueleto envolvido no transporte intracelular, mobilidade celular e divisão nuclear. Crédito:AMOLF
Os pesquisadores do AMOLF apresentaram uma teoria que descreve o atrito entre os filamentos biológicos que são reticulados por proteínas. Surpreendentemente, sua teoria prevê que a força de atrito é altamente não linear com o número de reticuladores. Os autores acreditam que as células usam esse dimensionamento não apenas para estabilizar as estruturas celulares, mas também para controlar seu tamanho. As novas descobertas são importantes para o entendimento da dinâmica das estruturas celulares, como o fuso mitótico, que separa os cromossomos durante a divisão celular.
Proteínas motoras versus forças de fricção
Muitas estruturas celulares consistem em longos filamentos que são reticulados por proteínas motoras e proteínas não motoras (veja a figura). Essas estruturas chamadas de citoesqueleto não apenas conferem às células sua estabilidade mecânica, mas também permite que eles rastejem sobre superfícies e separem os cromossomos durante a divisão celular. A geração de força é normalmente atribuída a proteínas motoras, que, usando combustível químico, pode mover os filamentos um em relação ao outro. Contudo, essas forças motoras são opostas por forças de atrito que são geradas por passivos, proteínas não motoras. Essas forças de atrito são um determinante central das propriedades mecânicas das estruturas do citoesqueleto, e eles limitam a velocidade e eficiência com que essas estruturas são formadas. Além disso, eles podem até ser vitais para sua estabilidade, porque se as forças motoras não forem opostas pelas forças de atrito geradas pelos reticuladores passivos, as estruturas podem até desmoronar.
Aumento exponencial
Para entender a dinâmica dessas estruturas citoesqueléticas e as forças que podem gerar, é essencial entender como as forças de atrito escalam com o comprimento dos filamentos e o número de reticuladores entre eles. As teorias existentes prevêem que o atrito aumenta linearmente com o número de reticuladores, que é o que se esperaria intuitivamente. Contudo, experimentos recentes demonstraram vividamente que as forças de atrito escalam de forma não linear, ou seja, exponencialmente, com o número de reticuladores. Devido à crise COVID-19, todos nós sabemos a diferença dramática que um aumento exponencial versus um linear pode fazer. Até agora, a origem deste comportamento de escala exponencial altamente incomum do atrito entre os filamentos não foi compreendida.
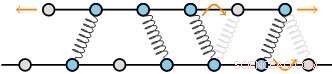
As estruturas do citoesqueleto consistem em filamentos reticulados por proteínas. Esses filamentos consistem em uma rede regular de subunidades, que produzem um conjunto discreto de locais de ligação para os reticuladores. A teoria dos autores prevê que, como resultado, as forças de atrito aumentam muito rapidamente à medida que o número de reticuladores aumenta. Crédito:AMOLF
Explicação
O líder do grupo AMOLF, Ten Wolde e Ph.D. o aluno Wierenga desenvolveu agora uma teoria que explica essas observações experimentais. Sua teoria é baseada na observação de que os filamentos biológicos consistem em uma rede regular de subunidades, produzindo um conjunto discreto de locais de ligação para os reticuladores. Ten Wolde e Wierenga prevêem que os filamentos só podem se mover se os ligantes se reorganizarem coletivamente. Como resultado desta reorganização coletiva, as forças de atrito aumentam muito rapidamente, ou seja, exponencialmente, com o número de linkers.
O trabalho dos autores tem implicações importantes para a nossa compreensão da dinâmica das estruturas do citoesqueleto. Em particular, a escala exponencial significa que essas estruturas congelam essencialmente quando a densidade do reticulador excede um certo limite; as forças de atrito tornam-se tão altas que proíbem qualquer movimento posterior. As células podem usar esse dimensionamento forte para controlar o tamanho e a estabilidade das estruturas celulares.