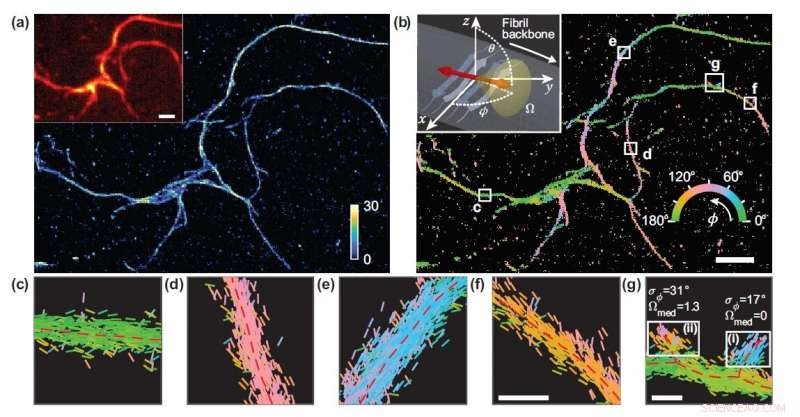
Os pesquisadores desenvolveram uma técnica de microscopia que mede a localização e orientação de moléculas individuais e a usaram para estudar os detalhes estruturais dos agregados de proteínas amilóides. (a) Imagem microscópica de localização de molécula única de uma rede de agregados amilóides. (b) Imagem mostrando as orientações de ligação do vermelho do Nilo às superfícies amilóides, codificado por cores de acordo com a orientação média medida em cada compartimento. (c-g) Medições de orientação individuais localizadas ao longo das estruturas de fibrila dentro das caixas brancas em (b). As linhas são orientadas e codificadas por cores de acordo com a direção do ângulo estimado. Barras horizontais de escala branca são marcadores de comprimento, 1 mícron em (a), (b) e 100 nm em (f), (g). Crédito:Tianben Ding, Tingting Wu e Matthew D. Lew, Washington University em St. Louis
Doenças neurodegenerativas, como Alzheimer e Parkinson, costumam ser acompanhadas por proteínas amilóides no cérebro que se aglomeraram ou se dobraram incorretamente. Uma técnica recentemente desenvolvida que mede a orientação de moléculas individuais está permitindo o uso de microscopia óptica, pela primeira vez, para revelar detalhes em nanoescala sobre as estruturas dessas proteínas problemáticas.
Pesquisadores da Washington University em St. Louis descrevem sua nova abordagem em Optica , O jornal da Sociedade Óptica.
"As doenças neurodegenerativas, como as doenças de Alzheimer e Parkinson, são as principais causas de morte em todo o mundo, "disse Tianben Ding, co-primeiro autor do novo artigo. "Esperamos que nossa abordagem de imagem de orientação de molécula única possa fornecer novos insights sobre a estrutura amilóide e possivelmente contribuir para o desenvolvimento futuro de terapêuticas eficazes contra essas doenças."
Os processos biológicos e químicos do cérebro são impulsionados por movimentos e interações complicadas entre as moléculas. Embora a maioria das proteínas amilóides possam ser atóxicas, o dobramento incorreto de até mesmo alguns poderia eventualmente matar muitos neurônios.
"Precisamos de tecnologias de imagem que possam observar esses movimentos moleculares em sistemas vivos para entender os mecanismos biológicos fundamentais das doenças, "explicou Matthew D. Lew, líder da equipe de pesquisa. "Doenças do tipo amiloide e príon, como Alzheimer, Parkinson e diabetes são nossos primeiros alvos para esta tecnologia, mas vemos isso sendo aplicado em muitas outras áreas também. "
Selecionando o melhor microscópio
O laboratório de Lew desenvolveu vários métodos de microscopia de super-resolução de molécula única que medem a orientação e a localização de moléculas fluorescentes ligadas a proteínas individuais. As informações de orientação são obtidas medindo não apenas a localização da fluorescência na amostra, mas também as características dessa luz, como polarização, que são normalmente ignorados na maioria das outras abordagens de microscopia.
Em seus Optica artigo, os pesquisadores descreveram uma métrica de desempenho que projetaram para caracterizar a sensibilidade com que vários microscópios podem medir as orientações de moléculas fluorescentes. Usando o novo indicador de desempenho, os pesquisadores descobriram que um microscópio que divide a luz de fluorescência em dois canais de polarização (x e y) fornece medições de orientação práticas e superiores.
"A métrica que desenvolvemos calcula o desempenho de um projeto específico de microscópio 1, 000 vezes mais rápido do que antes, "disse Tingting Wu, co-primeiro autor do trabalho. "Medindo as orientações de moléculas individuais ligadas a agregados amilóides, o microscópio selecionado nos permitiu mapear diferenças na organização da estrutura amilóide que não podem ser detectadas por microscópios de localização padrão. "
Uma vez que não há ligação artificial entre as sondas fluorescentes e as superfícies amilóides, a orientação de ligação das sondas às superfícies amilóides transmite informações sobre como a própria proteína amilóide está organizada. Os pesquisadores quantificaram como as orientações das moléculas fluorescentes variavam cada vez que uma era ligada a uma proteína amilóide. As diferenças nestes comportamentos de ligação podem ser atribuídas a diferenças estruturais entre os agregados amilóides. Como o método fornece informações de uma única molécula, os pesquisadores puderam observar as diferenças em nanoescala entre as estruturas amilóides sem tirar a média dos detalhes das características locais.
Oportunidades para estudos de longo prazo
"Planejamos estender o método para monitorar mudanças em nanoescala dentro e entre as estruturas amilóides à medida que se organizam por horas a dias, "disse Ding." Estudos de longo prazo de agregados amilóides podem revelar novas correlações entre como as proteínas amilóides são organizadas e quão rapidamente elas crescem ou se dissolvem espontaneamente. "
Os pesquisadores observam que a configuração que eles usaram para a microscopia de localização e orientação consistia em peças disponíveis comercialmente que são acessíveis a qualquer pessoa que execute microscopia de super-resolução de molécula única. Seu código de análise está disponível em https://github.com/Lew-Lab/RoSE-O.
"Em microscopia óptica e imagem, cientistas e engenheiros têm expandido os limites da imagem para ser mais rápida, sondar mais profundamente e ter maior resolução, "disse Lew." Nosso trabalho mostra que se pode lançar luz sobre os processos fundamentais da biologia, em vez de, com foco na orientação molecular, que pode revelar detalhes sobre o funcionamento interno da biologia que não podem ser visualizados pela microscopia tradicional. "