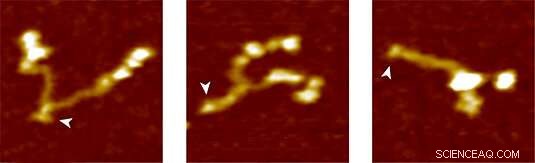
Proteína do Fator de Von Willebrand:totalmente aberta (esquerda), parcialmente fechada e totalmente fechada (direita). Crédito:Grupo Lipfert
Os físicos da LMU desenvolveram um método altamente sensível para medir a estabilidade mecânica das conformações de proteínas, e usou-o para monitorar os primeiros passos na formação de coágulos sanguíneos.
Como mediadores centrais da função celular em organismos biológicos, as proteínas estão envolvidas na execução de praticamente todos os processos celulares. Eles fornecem a estrutura interna que dá às células sua forma, e permitir que as células alterem dinamicamente sua morfologia. Eles transportam substratos para frente e para trás através das membranas, e eles catalisam a maioria das reações químicas que ocorrem nas células. No decorrer dessas tarefas, muitas proteínas são submetidas a forças externas. De fato, algumas proteínas "mecanossensíveis" medem efetivamente a força das forças que atuam sobre elas e são ativadas quando a força imposta excede um determinado valor limite. Fator de Von Willebrand (VWF), que inicia a formação de coágulos sanguíneos, é um importante representante desta classe.
As forças mecânicas necessárias para ativar proteínas como o VWF são frequentemente tão pequenas que sua magnitude não pode ser determinada usando os métodos existentes. Agora, uma equipe de cientistas liderada pelos físicos da LMU, Dr. Martin Benoit e pelo professor Jan Lipfert, desenvolveu um procedimento muito mais sensível. Suas "pinças magnéticas" podem quantificar forças que são 100 vezes menores do que o método alternativo comumente usado atualmente disponível. Como Lipfert e seus colegas relatam no jornal PNAS , eles empregaram a técnica para observar o desdobramento da proteína VWF sob a influência de baixas forças mecânicas.
Uma abordagem poderosa para estudar a mecanorregulação é a chamada espectroscopia de força de proteína. Isso envolve puxar uma molécula de proteína individual e observar como uma força aplicada altera sua estrutura tridimensional. Até agora, o método de escolha para puxar foi um microscópio de força atômica, que funciona melhor na faixa de 100 piconewton (pN). "Contudo, muitos processos moleculares são ativados por forças que são muito mais fracas do que isso, "diz Lipfert." Portanto, para medições no nível de moléculas individuais, precisamos de instrumentação mais sensível - não adianta usar uma balança de banheiro para pesar os ingredientes de um bolo. "
Os pesquisadores desenvolveram um método no qual as proteínas são fixadas em uma extremidade a uma superfície de vidro e carregam uma etiqueta na outra extremidade que se liga a minúsculas esferas magnéticas e a montagem é então submetida a um campo magnético externo. A extensão da proteína induzida pelo campo resulta no deslocamento vertical de cada conta, que pode ser detectado por microscopia. "Este tipo de configuração é conhecido como pinça magnética, "Lipfert explica." Tem a grande vantagem de nos permitir aplicar e resolver forças muito fracas - significativamente menos de 1 piconewton - à proteína de interesse. Além disso, as pinças magnéticas permitem medições muito estáveis por longos períodos de tempo - até uma semana. "
Para testar o novo método, o grupo LMU usou VWF como proteína alvo. Na corrente sanguínea, O VWF circula como um multímero de dímeros que são feitos de duas subunidades idênticas. Em condições normais de fluxo sanguíneo, tem uma forma globular relativamente compacta. Contudo, qualquer aumento nas forças de cisalhamento na corrente sanguínea devido a lesão da vasculatura causa o desenvolvimento do FvW. Isso expõe os locais de ligação para os receptores nas plaquetas sanguíneas. A ligação do VWF às plaquetas, por sua vez, desencadeia uma cascata de reação que leva à coagulação, que sela a ferida. “A cascata é induzida pela ação sobre a molécula de forças mecânicas que atuam muito mais fracas do que as medidas até agora, ", diz Lipfert. A análise da descompactação de dímeros de VWF com pinças magnéticas mostrou que a chamada haste de VWF se abre sob uma força aplicada de menos de 1 pN, quando as subunidades do dímero são separadas como as duas metades de um zíper. “Presumimos que este padrão de comportamento, que pudemos observar pela primeira vez, representa a primeira etapa na coagulação do sangue, "diz Lipfert." Nossa abordagem fornece uma imagem detalhada das forças e as mudanças na extensão envolvidas no desdobramento da proteína. Estamos confiantes de que a aplicação futura do método contribuirá para uma melhor compreensão do modo de ação do VWF e do papel das mutações clinicamente relevantes.