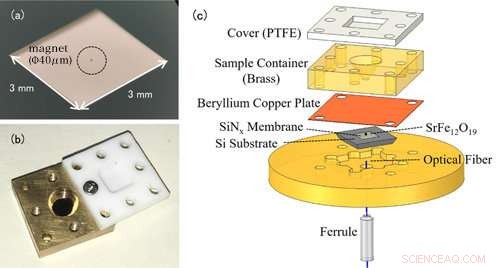
Figura 1:(a) Foto de uma nanomembrana. A própria nanomembrana é muito fina (100 nm), por isso parece transparente a olho nu. O item circundado no centro é um pequeno ímã para detecção de EPR. (b) Foto da célula de solução. O recipiente é coberto com uma tampa de Teflon para evitar que a amostra da solução evapore. (c) A configuração experimental da espectroscopia EPR com detecção de força. A célula de solução contendo a amostra de medição é colocada acima da membrana com ímãs anexados. Mudanças na nanomembrana são detectadas pela fibra óptica abaixo da membrana. Crédito:Kobe University
Os pesquisadores desenvolveram um novo método para analisar metaloproteínas com apenas uma pequena amostra de líquido. Esta descoberta foi alcançada por uma equipe de pesquisa liderada pelo Professor Associado Eiji Ohmichi e Tsubasa Okamoto na Escola de Graduação em Ciências da Universidade de Kobe. Os resultados foram publicados em 28 de novembro em Cartas de Física Aplicada .
Metaloproteínas (também conhecidas como proteínas de ligação a metais) desempenham papéis vitais para o transporte e armazenamento de oxigênio, transporte de elétrons, oxidação e redução. Em muitos casos, os íons metálicos nessas proteínas são os centros ativos para essas atividades, então, ao identificar o estado exato desses íons, podemos entender os mecanismos por trás de suas funções.
Um método experimental denominado ressonância paramagnética de elétrons (EPR) pode ser usado para medir o estado de íons de elétrons em proteínas. As técnicas EPR eficazes requerem uma certa quantidade de volume de amostra para medições sensíveis. Contudo, muitas metaloproteínas são difíceis de isolar e refinar, portanto, os pesquisadores só podem obter pequenas amostras.
As medições EPR convencionais detectam as ondas eletromagnéticas absorvidas por íons metálicos. A característica notável deste estudo é o uso de um dispositivo em forma de trampolim denominado nanomembrana (figura 1 (a)). Em EPR, as transições de spin do elétron para um estado de alta energia, absorvendo ondas eletromagnéticas, mas ao mesmo tempo, a direção do giro inverte, e as propriedades magnéticas dos íons metálicos também mudam. Antes do experimento, a equipe de pesquisa anexou pequenos ímãs à nanomembrana, então as mudanças na força de atração entre os ímãs e os íons metálicos são transformadas em uma força na nanomembrana, e este sinal EPR é detectado. Como a nanomembrana é muito fina - apenas 100 nm (=0,1 μm), podemos medir com sensibilidade pequenas mudanças na força que acompanham a absorção de EPR.
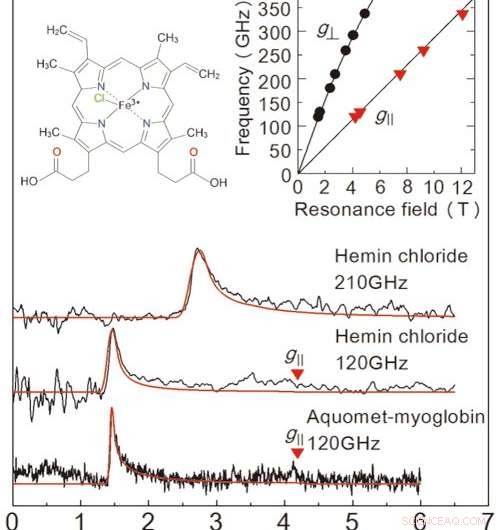
Figura 2:Resultados das medidas de EPR obtidas neste estudo a partir de uma amostra de solução congelada. Os dois diagramas principais são para cloreto de hemina, e o gráfico na parte inferior é para a mioglobina. A linha vermelha é um sinal projetado de um simulador de valor. As concentrações da solução e os volumes de amostra foram 50 mM 、 2 μL para cloreto de hemina, e 8,8 mM 、 10 μL para mioglobina. As medições ocorreram a 4,2 K. Ao examinar as duas linhas no gráfico superior direito, podemos determinar o estado exato dos íons de ferro. O gráfico superior esquerdo mostra a estrutura molecular do cloreto de hemina. Crédito:Kobe University
A amostra da solução é colocada em uma célula de solução diretamente acima da membrana (figura 1 (b)). O volume da célula é de apenas 50μL (=0,05 cc), e a equipe adiciona cerca de 1-10μL (0,001-0,01 cc) de solução para medição. Para evitar que a solução evapore, a célula é coberta com uma tampa de resina. Neste método, a nanomembrana fina e frágil é independente da célula de solução, facilitando a troca de amostras (figura 1 (c)).
Para avaliar o desempenho desta configuração, a equipe realizou medições de EPR em alta frequência (acima de 0,1 THz) para uma proteína contendo ferro chamada mioglobina e seu complexo modelo de cloreto de hemina (figura 2). A equipe conseguiu detectar sinais EPR em uma ampla frequência de onda (0,1-0,35 THz) para uma concentração de 50 mM, 2 μL de solução de cloreto de hemina. Eles também observaram um sinal EPR característico para 8,8 mM, Amostra de 10μL de solução de mioglobina. Uma grande vantagem deste método é a capacidade de medir em uma ampla faixa de frequência, tornando-o aplicável para metaloproteínas com uma variedade de propriedades magnéticas.
O professor Ohmichi comenta:"Este novo método torna possível determinar em um nível detalhado o estado dos íons metálicos em uma pequena quantidade de solução de metaloproteína. Podemos ser capazes de aplicar o método a metaloproteínas que anteriormente não podiam ser medidas. Por exemplo , em nosso metabolismo, uma metaloproteína chamada peroxidase desempenha um papel crucial ao converter o peróxido de hidrogênio em água, tornando-o inofensivo, mas os detalhes do mecanismo desse processo reativo ainda não são claros. Os resultados deste estudo podem ser potencialmente aplicados como um método de análise líder para lançar luz sobre esse tipo de fenômeno vital. "