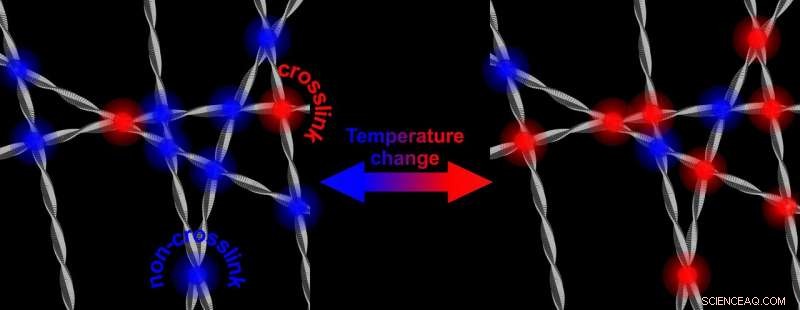
 p Em temperaturas mais altas, há mais ligações cruzadas que enrijecem a rede de fibrilas de proteína. A redução da temperatura resulta em uma rede que é novamente menos rígida. Crédito:University of Twente
p Em temperaturas mais altas, há mais ligações cruzadas que enrijecem a rede de fibrilas de proteína. A redução da temperatura resulta em uma rede que é novamente menos rígida. Crédito:University of Twente
p Fibrilas da proteína alfa-sinucleína, que desempenha um papel na doença de Parkinson, formam uma rede mais rígida e mais forte na água, quando a temperatura é aumentada. Pesquisadores da Universidade de Twente mostram que isso tem a ver com a parte hidrorrepelente das fibras que vêm à superfície e interagem. O mecanismo também pode desempenhar um papel na interação com células saudáveis. Pesquisadores da Universidade de Twente publicam sobre isso em
Cartas de revisão física de 17 de maio. p A alfa-sinucleína é abundante em nosso cérebro. Sabe-se que ele pode se voltar contra nós:em doenças neurodegenerativas como o Parkinson, a proteína mostra um comportamento aberrante:após formar fibrilas, a proteína pode formar placas. Ainda não se sabe como funciona esse mecanismo. A pesquisa agora apresentada pelos cientistas da UT, mostra que as propriedades da alfa-sinucleína são "ajustáveis". No laboratório, na água, eles formarão uma rede mais rígida e mais forte quando a temperatura aumentar. Baixando a temperatura novamente, a rede fica menos rígida novamente. Embora tudo isso aconteça em uma faixa de temperatura que nunca ocorrerá no cérebro, o mecanismo subjacente pode fornecer mais informações sobre o papel que as proteínas desempenham no início da doença. A rigidez ajustável é induzida por 'interação hidrofóbica':a parte repelente de água das fibras é a chave.
p A pesquisa que agora é apresentada em
Cartas de revisão física , mostra que o fortalecimento da rede é causado pelo aumento do número de pontos de contato das fibrilas. Todos esses pontos de contato estão nas partes hidrofóbicas da alfa-sinucleína. A razão pela qual isso é notável, é que a parte hidrofóbica normalmente é "protegida" pelos outros dois blocos de construção da proteína:uma parte com carga elétrica e uma parte anfifílica (gosta tanto de água quanto de lipídios). Tirando esse escudo e abrindo a parte hidrofóbica, também pode desempenhar um papel na doença:essa parte é capaz de danificar células saudáveis.
p Até os próprios mecanismos naturais de defesa do ser humano podem trabalhar contra nós, nesse caso. Pesquisas anteriores mostraram que a 'limpeza' das proteínas hostis normalmente é feita 'cortando' a parte que está eletricamente carregada, tirando assim o escudo da parte hidrofóbica. As fibrilas agora podem encontrar pontos de contato, formam redes e atacam as membranas celulares. Desta maneira, a proteção natural é retirada.
p A pesquisa ajuda a entender os mecanismos, mas também pode inspirar, por exemplo nanotecnologistas para a criação de novos tipos de estruturas artificiais que podem ser ajustadas. À primeira vista, o enrijecimento da rede é conhecido por polímeros, mas a interação hidrofóbica é um mecanismo totalmente diferente que também pode ser usado em estruturas artificiais.
