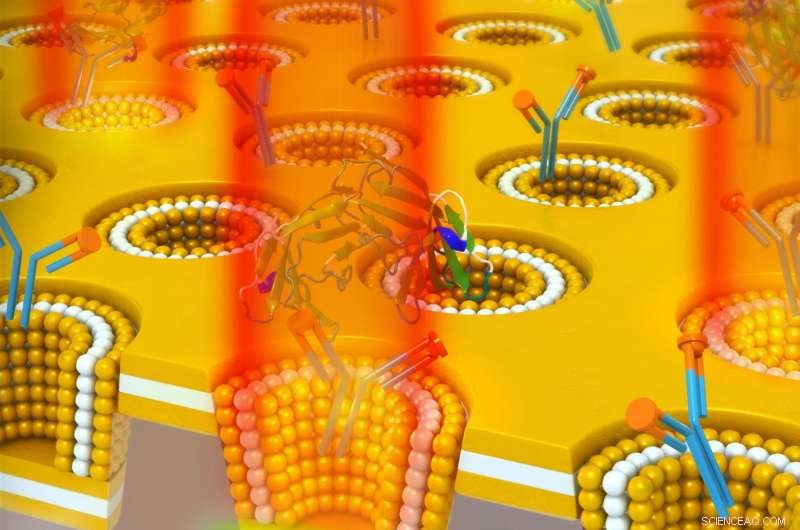
Um projeto de cavidade de metal-isolador de metal nanocup plasmônico usado para detectar o biomarcador de câncer CEA. A nanocavidade leva ao armazenamento de energia óptica que é acoplada ao campo distante por um aumento do índice de refração. Portanto, A ligação do CEA ao seu anticorpo imobilizado leva a um aumento sensível na intensidade de transmissão no comprimento de onda de ressonância sem deslocamento espectral. Crédito:Universidade de Illinois
Um novo sensor plasmônico desenvolvido por pesquisadores da Universidade de Illinois em Urbana-Champaign servirá como uma detecção precoce confiável de biomarcadores para muitas formas de câncer e, eventualmente, outras doenças.
O sensor tem se mostrado confiável para detectar a presença do antígeno carcinoembrionário biomarcador de câncer (CEA) na magnitude de 1 nanograma por mililitro. A maioria dos humanos carrega pelo menos algumas quantidades de CEA com um intervalo médio de 3-5 nanogramas por mililitro. Os pesquisadores optaram por se concentrar no CEA porque sua presença em concentrações mais elevadas é um indicador precoce de muitas formas de câncer, incluindo câncer de pulmão e próstata.
"O câncer é uma das principais causas de morte nos Estados Unidos, pois mais da metade dos novos pacientes são diagnosticados depois de já ter se espalhado, "Ameen explicou." Isso mostra a gravidade com que este problema precisa ser tratado e este novo design de um sensor plasmônico ajuda a detectar a concentração mais baixa de CEA em um estado anterior. "
O sensor plasmônico é um aprimoramento do método atual de última geração por alguns motivos. Primeiro, foi capaz de melhorar o limite de detecção em pelo menos duas ordens de magnitude. Na verdade, a maioria dos métodos não é capaz de detectar com precisão a presença de CEA até que ele atinja uma concentração mais alta.
Em segundo lugar, porque funciona com muito menos instrumentação, é menos caro e mais portátil e não requer quase nenhum conhecimento para fazer uma leitura. Também significa que, em vez de precisar de um frasco de sangue para um teste, uma simples picada no dedo bastará. Este aspecto será especialmente importante para aqueles que não moram perto de instalações médicas avançadas, incluindo aqueles em nações em desenvolvimento.
A equipe de pesquisa foi liderada por Logan Liu, e Lynford Goddard, professores associados de engenharia elétrica e da computação com os alunos Abid Ameen e Lisa Hackett realizando o projeto. A equipe publicou seus resultados em Materiais Óticos Avançados como um artigo de capa.
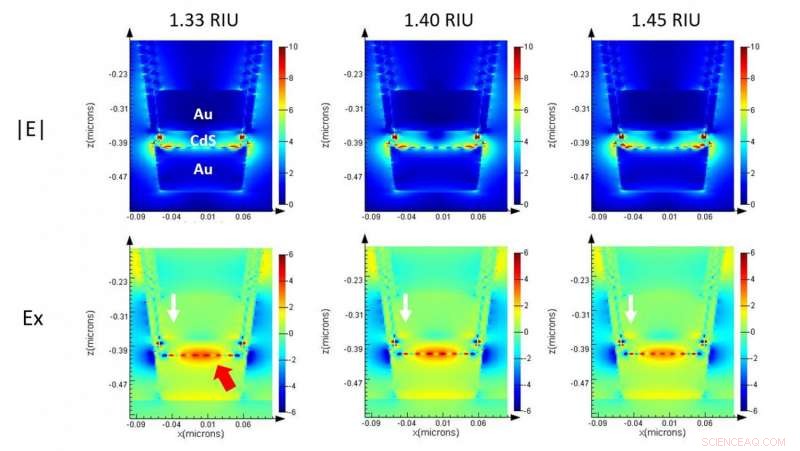
Simulação eletromagnética de uma única nanocup em ML-nanoLCA mostrando a intensidade do campo na seção transversal. Crédito:Universidade de Illinois
O dispositivo combina dois métodos de detecção, que não tinha até agora sido capaz de ser usado junto. Primeiro, ele usa uma nanocavidade multi-camada 3D em uma matriz nanocup, o que permite que a luz seja armazenada na cavidade composta por duas camadas de metal (neste caso ouro) em torno de uma camada isolante.
Em segundo lugar, ele usa detecção plasmônica, que detecta interações de matéria-luz em nanoescala sensíveis com biomoléculas na superfície do dispositivo. Produz um confinamento de campo aprimorado e um campo localizado aprimorado. Por causa da estrutura plasmônica, a luz é acoplada de maneira mais eficiente à medida que o índice de refração circundante muda.
"Ao combinar as propriedades plasmônicas e as propriedades da cavidade óptica juntas em um dispositivo, somos capazes de detectar a menor concentração de biomarcador por confinamento de luz e transmissão na camada da cavidade e da parte superior do dispositivo, respectivamente, com base na espessura das multicamadas e no índice de refração da camada da cavidade, "Ameen explicou.
"A matriz nanocup oferece uma transmissão ótica extraordinária, "Hackett acrescentou." Se você pegar uma película fina de metal e tentar iluminar através dela, quase nenhuma luz será transmitida. No entanto, se você colocar uma matriz periódica de nanoholes, ou no nosso caso, uma estrutura nanocup, então o que você vê é uma condição de ressonância onde, em um determinado comprimento de onda, você terá um pico na transmissão por meio deste dispositivo. "
Como a ressonância está mudando em um único comprimento de onda e as características espectrais têm localizações de referência, a excitação e a detecção podem ser feitas de forma confiável, sem nenhum equipamento especializado. Com este dispositivo, uma fonte de luz LED pode ser usada em vez de um laser e uma fotocélula ou imagem de câmera pode ser usada em vez de um espectrômetro de última geração.
"Por causa de nossa estrutura plasmônica de alto desempenho multicamadas, fomos capazes de espalhar de forma muito eficiente a luz para o campo distante, "Hackett disse." Quando você aumenta o índice de refração da região de detecção, faz com que a energia armazenada se acople. Normalmente, quando você tem esses tipos de sensores plasmônicos refratométricos, você tem uma mudança no ângulo ou no comprimento de onda quando a condição de ressonância é satisfeita. No nosso caso, porque incorporamos uma nanocavidade, temos um comprimento de onda de ressonância fixo. "
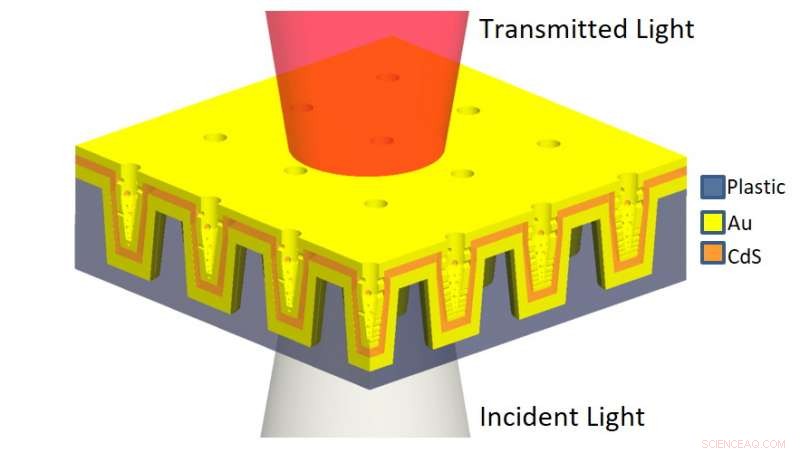
A ilustração esquemática da nanoLCA de multicamadas (ML-nanoLCA) mostra a estrutura de multicamadas e a direção da iluminação. Crédito:Universidade de Illinois em Urbana-Champaign
À medida que a concentração de biomoléculas (neste caso, CEA) aumenta, o mesmo acontece com o índice de refração, que produz um aumento da intensidade de transmissão em um comprimento de onda fixo que pode ser facilmente detectado.
"O que isso significa no futuro é que podemos usar este sensor, que otimizamos e incorporamos com um LED e temos a instrumentação mais compacta, na verdade, nenhuma instrumentação sofisticada, "Ameen disse." Isso permite a detecção plasmônica de alto desempenho a capacidade de ir para sistemas de detecção portáteis e sensores portáteis de grande escala. "
Por enquanto, métodos de detecção de biomarcadores de câncer estão sendo implementados em pacientes de alto risco, especialmente pacientes com câncer em remissão. Eles levam tempo, equipamento especializado, e são trabalhosos.
No futuro, Contudo, devido à portabilidade e à natureza econômica deste método, pode ser administrado mais facilmente a qualquer paciente em check-ups de rotina. Isso permitiria que aqueles com uma concentração elevada de CEA fossem tratados antes mesmo de as células cancerosas se espalharem pelo corpo.
"No momento, o câncer é detectado próximo ao estágio final, "Ameen observou." Queremos detectá-lo o mais cedo possível. Nosso dispositivo está nos proporcionando essa oportunidade. "
Embora este estudo tenha demonstrado detecção em uma pequena amostra de soro humano, o método poderia ser usado para a detecção de outras doenças no futuro.
"No futuro, se forem muito econômicos e portáteis, "Hackett disse, "seria ótimo ver as pessoas serem capazes de ter mais controle sobre sua saúde e monitorar algo assim por conta própria."