
Radiografia do bocal de trabalho, mostrando a corrente protéica interna rodeada pelo jato de etanol. Crédito:Dominik Oberthuer, DESY
Os cientistas estão interessados na estrutura espacial das proteínas para aprender sobre o funcionamento dessas biomoléculas. Esse conhecimento pode levar a uma melhor compreensão das funções das biomoléculas e a medicamentos sob medida. A cristalografia de raios X é a principal ferramenta para solucionar estruturas de proteínas. Contudo, requer cristais crescentes das proteínas sob investigação. Quando os raios X atingem esses cristais, eles são difratados dos átomos para formar um padrão característico a partir do qual a estrutura espacial do cristal - e, portanto, das moléculas de proteína - pode ser calculada.
Contudo, muitas proteínas não gostam de ser comprimidas em cristais, pois isso contradiz seu estado natural. "O cultivo de cristais de proteína é complexo. A quantidade de proteína que pode ser produzida costuma ser limitada a alguns milionésimos de grama, e frequentemente, apenas cristais muito pequenos podem ser obtidos, "diz Dominik Oberthür da DESY, autor principal do relatório. Com os flashes extremamente brilhantes dos lasers de elétrons livres de raios-X, mesmo esses microcristais podem ser analisados, mas geralmente milhares de padrões de difração são necessários para resolver a estrutura da proteína. Uma vez que os delicados microcristais são completamente vaporizados pelo intenso flash de raios-X após a entrega de seu padrão de difração, um fluxo de microcristais novos é enviado através do feixe de laser. Este conceito é conhecido como cristalografia de raios-X serial, e permitiu a análise de muitas proteínas anteriormente inacessíveis.
Ainda, mesmo aqueles microcristais são difíceis de obter, e apenas uma fração é realmente atingida pelo flash de raio-X, dependendo da geometria do fluxo de cristal e dos parâmetros técnicos do laser de raios-X. "Quanto menos cristais, menos material proteico você precisa, mais viável é a análise, "diz Oberthür. A equipe de Bajt concebeu um novo conceito para um chamado bico de foco de fluxo duplo (DFFN) que reduz muito o consumo de cristal de proteína. Normalmente, os cristais de proteína são injetados com algum tampão líquido transportador no feixe de raios-X usando um bico especial. Para formar um jato fino, o líquido transportador é acelerado por um fluxo rápido de gás em torno do líquido. Mas para formar um jato estável, uma taxa de fluxo mínima é necessária, geralmente desperdiçando a maioria dos cristais no jato.

Conceito do novo bico:um jato rápido de gás (branco) acelera um jato de etanol (azul) no qual o tampão portador de cristais de proteína (verde) é injetado. Crédito:Anton Barty, DESY, e Juraj Knoška, Universität Hamburgo
Para superar essas dificuldades, a equipe adicionou etanol como um líquido de "revestimento" secundário entre o gás e o buffer. Isso faz com que o líquido da bainha seja acelerado pelo gás. Os cristais em seu buffer podem então ser injetados como um fluxo muito fino no centro do jato de etanol. "Antes, o buffer com os cristais tinha que fazer duas tarefas:formar um jato estável e transportar cristais de proteína, "explicou Juraj Knoška, um Ph.D. estudante do CFEL e da Universidade de Hamburgo, quem desenvolveu os bicos. "Nossa abordagem separa essas funções e usa os melhores líquidos para o trabalho." O etanol tem características ideais para formar um jato muito estável, que flui com apenas um fluxo fino do buffer de transporte de cristal no centro. Por aqui, o caudal do tampão pode ser reduzido de cerca de 40 microlitros (milionésimos de litro) para apenas dois microlitros por minuto. Também, a multa, um fluxo estável de nanocristais pode ser mantido precisamente sobreposto ao pequeno feixe do laser de raios-X. Além disso, a redução na taxa de fluxo geral melhora a qualidade dos padrões de difração e a taxa na qual os cristais são realmente atingidos pelos flashes de raios-X.
"Não só reduzimos o consumo de cristal, mas nosso bico de foco de fluxo duplo também torna o uso da fonte de raios-X mais eficiente, aumentando a taxa na qual coletamos padrões de difração de alta qualidade, "diz Bajt." Além disso, usar o líquido da bainha nos permite investigar proteínas em buffers que não podiam ser injetadas antes. Nosso conceito amplia o espectro de biomoléculas que podem ser analisadas. "Sua equipe testou o novo bico no LCLS de laser de raios X do SLAC National Accelerator Laboratory nos EUA. Os cientistas se uniram a diferentes grupos para resolver as estruturas de várias proteínas .
"Junto com o grupo do Prêmio Nobel Roger Kornberg da Universidade de Stanford, poderíamos resolver a estrutura da enzima RNA polimerase II à temperatura ambiente pela primeira vez, "explica Oberthür." Uma vez que a cristalografia à temperatura ambiente é um pré-requisito para estudar a dinâmica estrutural em detalhes, isso abre a porta para futuros estudos resolvidos pelo tempo ou 'filmes moleculares' com este importante sistema. "O novo dispositivo também foi usado para analisar duas outras enzimas, uma hidrogenase ligada à membrana e uma dioxigenase, bem como nano cristais de proteína de ocorrência natural, do casulo protetor de um vírus especializado (Cydia pomonella granulovirus, CpGV).
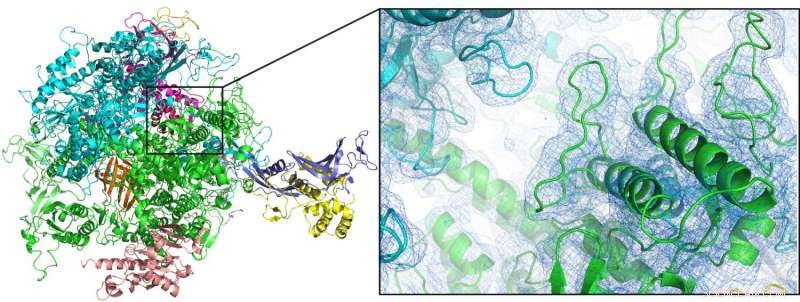
A primeira estrutura à temperatura ambiente da enzima RNA polimerase II (aqui mostrada como um desenho animado) poderia ser resolvida por cristalografia de femtossegundo em série usando um bico focado em fluxo duplo. Crédito:Dave Bushnell, Universidade de Stanford, e Dominik Oberthür, DESY
O bico de foco de fluxo duplo também elimina outro problema prático desta forma de injeção a jato:Normalmente, na borda de bicos convencionais, material tampão, proteínas e cristais de gelo de água agregam-se ao longo do tempo para formar características semelhantes a gotas. O mesmo acontece frequentemente no fundo do tanque de coleta abaixo do bocal. Se essas estalactites e estalagmites de proteína-gelo crescerem no feixe de raios-X, eles não apenas tornam o padrão de difração inútil, seus reflexos podem ser tão fortes que destroem o detector. Então, de vez em quando, experimentos precisam ser suspensos para remover as gotas de proteína-gelo. "O líquido da bainha em nosso bico evita a formação de tais estruturas indesejadas. O bico de foco de fluxo duplo permitiu condições experimentais estáveis por muitas horas, "explica Oberthür.
"Em todos os experimentos, o bico funcionou extremamente bem, "resume Bajt." Poderíamos reduzir o número de interrupções de dez para zero em um turno, e esperamos que as estações experimentais em outros lasers de raios-X e em fontes de luz síncrotron como o PETRA III da DESY também possam se beneficiar das vantagens de nosso dispositivo. "