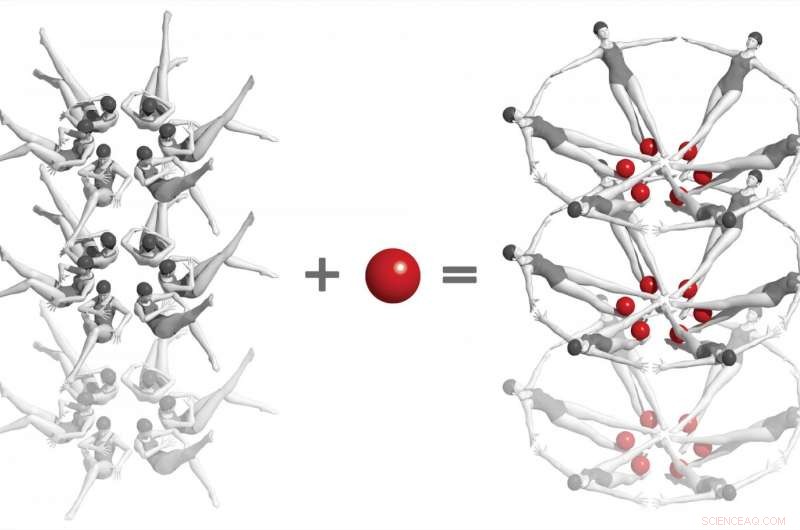
Em um experimento marcante no SLAC National Accelerator Laboratory, os cientistas usaram um laser de raios-X para capturar os primeiros instantâneos de uma interação química entre duas biomoléculas em tempo real e em nível atômico. Envolve 'riboswitches' do RNA bacteriano - mostrado aqui como nadadores sincronizados - e uma pequena molécula chamada adenina (bolas vermelhas). Quando os dois interagem, riboswitches mudam em uma forma dramaticamente diferente, e isso, por sua vez, muda a forma dos cristais nos quais estão embutidos. Estudos como esses, que só pode ser feito em lasers de elétrons livres de raios-X, abre um caminho para a compreensão de como o RNA e outras biomoléculas complexas funcionam, e, finalmente, para o desenvolvimento de tratamentos para doenças. Crédito:Joseph Meyer / Frederick National Laboratory for Cancer Research
Os cientistas usaram o poderoso laser de raios-X no Laboratório Nacional do Acelerador SLAC do Departamento de Energia para fazer os primeiros instantâneos de uma interação química entre duas biomoléculas - uma que aciona uma "chave" de RNA que regula a produção de proteínas, as moléculas burras da vida.
Os resultados, publicado hoje em Natureza , mostram o potencial de mudança de jogo dos lasers de elétrons livres de raios-X, ou XFELs, para estudar RNA, que orienta a fabricação de proteínas na célula, serve como material genético primário em retrovírus como o HIV e também desempenha um papel na maioria das formas de câncer.
E porque este tipo particular de switch de RNA, conhecido como riboswitch, é encontrado apenas em bactérias, uma compreensão mais profunda de sua função pode oferecer uma maneira de desligar a produção de proteínas e matar germes nocivos sem causar efeitos colaterais nos seres humanos que infectam.
"Experimentos anteriores no laser de raios-X do SLAC estudaram reações biológicas como a fotossíntese que são desencadeadas pela luz. Mas este é o primeiro a observar uma que é desencadeada pela interação química de duas biomoléculas em tempo real e em escala atômica, "disse Yun-Xing Wang, um biólogo estrutural do Centro de Pesquisa do Câncer do Instituto Nacional do Câncer que liderou a equipe de pesquisa internacional.
"Isso realmente demonstra a capacidade única que os lasers de elétrons livres de raios-X oferecem que nenhuma tecnologia atual, ou qualquer outra tecnologia no horizonte, pode fazer. É como se você tivesse uma câmera com uma velocidade de obturador muito rápida, para que você possa capturar cada movimento das biomoléculas em ação. "
Os experimentos foram realizados na Linac Coherent Light Source (LCLS) da SLAC, um DOE Office of Science User Facility. Eles são os primeiros a demonstrar como os XFELs podem tirar instantâneos e, potencialmente, fazer filmes de RNA e outras biomoléculas enquanto interagem quimicamente - oferecendo vislumbres do funcionamento fundamental da célula que não pode ser obtido de outra forma.
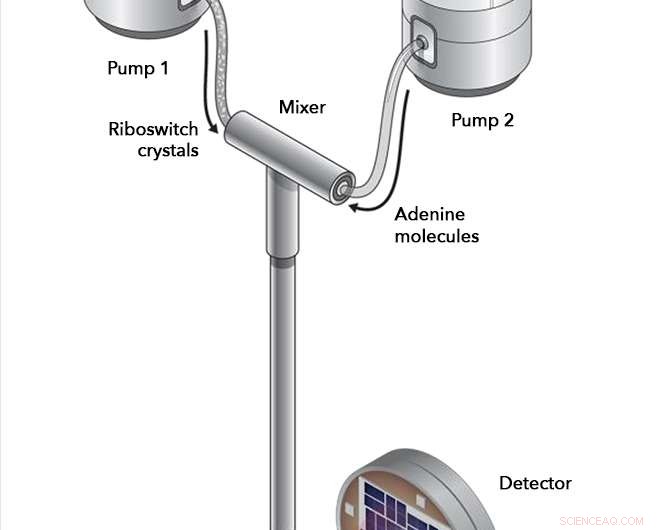
Em experimentos na Linac Coherent Light Source da SLAC, cristais riboswitch e moléculas de adenina foram bombeados para uma câmara de mistura, onde eles foram autorizados a interagir por intervalos cuidadosamente cronometrados antes de serem injetados no caminho do feixe de laser de raios-X. Os raios X ricochetearam nas moléculas do riboswitch e em um detector, registrando quaisquer mudanças na estrutura do riboswitch que ocorreram. Crédito:Joseph Meyer / Instituto Nacional do Câncer
Observando a Mudança de Forma de RNA
O RNA é uma parte fundamental do material genético em todas as células vivas. Ele vem em vários tipos que atuam juntos para orientar a produção de proteínas pelos ribossomos da célula, de acordo com projetos codificados em DNA.
Mas tanto o DNA quanto o RNA também contêm extensas regiões que não codificam nenhuma proteína - a chamada "matéria escura" genética. Os cientistas pensaram por muitos anos que essas regiões não faziam nada. Agora eles sabem que desempenham um papel importante na determinação de onde e quando os genes são ativados e desativados e, de outra forma, no ajuste fino de sua função. A grande maioria dos cânceres é devido a mutações nessas regiões não codificantes, Wang disse, portanto, compreender como essas regiões funcionam é importante para a pesquisa do câncer, bem como para a biologia fundamental.
Contudo, descobrir o que as regiões não codificantes de RNA fazem é difícil. As moléculas de RNA são instáveis e flexíveis, portanto, é difícil incorporá-los aos grandes cristais normalmente necessários para estudar sua estrutura atômica em fontes de luz de raios-X.
O LCLS remove essa barreira, permitindo que os cientistas obtenham informações estruturais de muito menores, cristais nanométricos, que são muito mais fáceis de fazer. Seus poderosos pulsos de laser de raios-X, um bilhão de vezes mais brilhante do que qualquer disponível antes, são tão curtos que coletam dados de cada cristal em alguns milionésimos de bilionésimo de segundo, antes que os danos dos raios X ocorram.
A equipe de Wang estudou um riboswitch de Vibrio vulnificus, uma bactéria relacionada àquela que causa a cólera. O riboswitch fica em uma longa fita de RNA mensageiro (mRNA), que copia as instruções do DNA para fazer uma proteína para que possam ser lidas e executadas pelo ribossomo. O interruptor atua como um termostato que regula a produção de proteínas.
Nesse caso, o mRNA orienta a produção de uma proteína que, por sua vez, ajuda a produzir uma pequena molécula chamada adenina. Quando há muita adenina na célula bacteriana, as moléculas de adenina entram em bolsões nos riboswitches e mudam os riboswitches para uma forma diferente, e isso muda o ritmo da produção de proteína e adenina.
Primeiras fotos de um filme elegante
Para os experimentos LCLS, os pesquisadores fizeram nanocristais que incorporaram milhões de cópias do riboswitch e os misturaram com uma solução contendo moléculas de adenina. Cada cristal era tão pequeno que a adenina podia penetrar rápida e uniformemente em cada canto dele, entrar nos bolsos do riboswitch e virá-los quase que instantaneamente, como se fossem milhões de nadadores sincronizados executando um único movimento perfeito.
Os cientistas tiraram fotos dessa interação atingindo os cristais com pulsos de laser de raios-X em intervalos cuidadosamente cronometrados após o início da mistura. Isso deu a eles o primeiro vislumbre de um estágio intermediário fugaz no processo, que ocorreu em 10 segundos. Separadamente, eles obtiveram as primeiras imagens do riboswitch em sua inicial, estado de bolso vazio, e descobri que existia em duas configurações ligeiramente diferentes, apenas um deles participa da troca.
Os pesquisadores ficaram surpresos ao descobrir que a mudança repentina na forma dos riboswitches foi tão dramática que mudou a forma de todo o cristal, também. Normalmente, uma grande mudança como essa quebraria o cristal e estragaria o experimento. Mas porque esses cristais eram tão pequenos que se mantinham juntos, então o laser de raios-X ainda poderia obter informações estruturais deles.
"Para mim ainda é um mistério como o cristal conseguiu fazer isso, "disse Soichi Wakatsuki, professor do SLAC e da Stanford School of Medicine e chefe da Divisão de Biociências do laboratório, que não fazia parte da equipe de pesquisa. "Isso realmente abre muitas novas possibilidades e nos dá uma nova maneira de ver como o RNA e as proteínas interagem com pequenas moléculas, então isso é muito emocionante. "