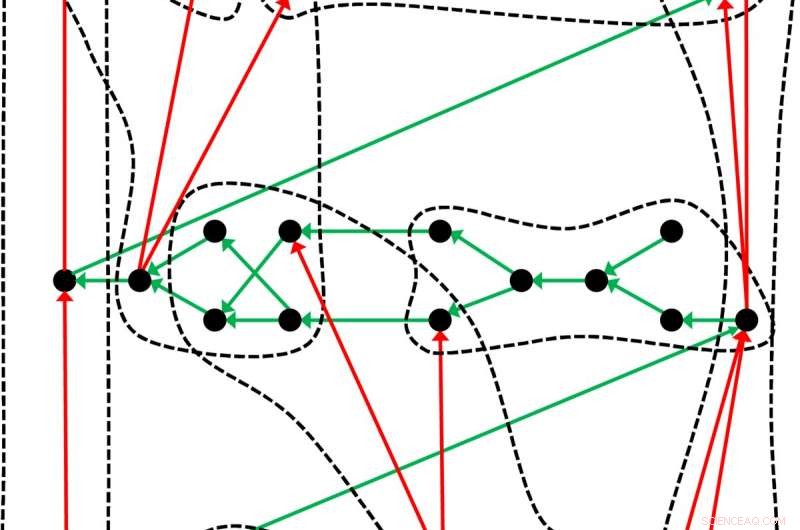
 p Uma tabela periódica ligeiramente diferente:a tabela dos elementos químicos, que remonta a Dmitri Mendeleev e Lothar Meyer, é apenas um exemplo de como os objetos - neste caso, os elementos químicos - podem ser organizados em tal sistema. Os pesquisadores de Leipzig ilustram a estrutura geral de uma tabela periódica com este exemplo:Os pontos pretos representam os objetos ordenados pelas setas verdes. Usando um critério adequado, os objetos podem ser classificados em grupos (linhas tracejadas) nos quais as setas vermelhas criam uma sub-ordem. Crédito:Guillermo Restrepo, MPI para Matemática nas Ciências
p Uma tabela periódica ligeiramente diferente:a tabela dos elementos químicos, que remonta a Dmitri Mendeleev e Lothar Meyer, é apenas um exemplo de como os objetos - neste caso, os elementos químicos - podem ser organizados em tal sistema. Os pesquisadores de Leipzig ilustram a estrutura geral de uma tabela periódica com este exemplo:Os pontos pretos representam os objetos ordenados pelas setas verdes. Usando um critério adequado, os objetos podem ser classificados em grupos (linhas tracejadas) nos quais as setas vermelhas criam uma sub-ordem. Crédito:Guillermo Restrepo, MPI para Matemática nas Ciências
p A tabela periódica de elementos que a maioria dos livros de química descreve é apenas um caso especial. Esta visão geral tabular dos elementos químicos, que remonta a Dmitri Mendeleev e Lothar Meyer e às abordagens de outros químicos para organizar os elementos, envolvem diferentes formas de representação de uma estrutura oculta dos elementos químicos. Esta é a conclusão a que chegaram pesquisadores do Instituto Max Planck de Matemática nas Ciências de Leipzig e da Universidade de Leipzig em um artigo recente. A abordagem matemática dos cientistas de Leipzig é muito geral e pode fornecer muitos sistemas periódicos diferentes, dependendo do princípio de ordem e classificação - não apenas para a química, mas também para muitos outros campos do conhecimento. p É um ícone das ciências naturais e está presente na maioria das salas de aula de química:a tabela periódica dos elementos, que está celebrando seu 150º aniversário este ano. A visão geral tabular está intimamente ligada a Dmitri Mendeleev e Lothar Meyer - dois pesquisadores que, na década de 1860, criou um arranjo de elementos com base em suas massas atômicas e semelhanças. Hoje, eles são classificados por número atômico (que indica o número de prótons no núcleo atômico) do hidrogênio leve (um próton) ao orgão sintético (118 prótons). Os elementos também são classificados em grupos:Átomos na mesma coluna geralmente têm o mesmo número de elétrons em sua camada externa.
p
Tabela periódica em diferentes variantes
p À primeira vista, a tabela periódica parece ter trazido uma ordem inequívoca e final aos 118 elementos atualmente conhecidos. Mas as aparências podem enganar porque muitas coisas ainda permanecem controversas:os cientistas não concordam exatamente sobre quais elementos pertencem ao terceiro grupo abaixo do escândio e do ítrio. Por exemplo, a posição correta do lantânio e do actínio é debatida. Se olharmos mais de perto, descobriremos variantes ligeiramente diferentes da tabela periódica nas salas de aula, Salas de leitura, e livros didáticos.
p Guillermo Restrepo e Wilmer Leal do Instituto Max Planck de Matemática nas Ciências e da Universidade de Leipzig não se surpreendem. Para eles, não existe uma disposição inequivocamente correta dos elementos; dependendo do critério aplicado para classificação, resultados de uma tabela periódica diferente. Os átomos podem ser subdivididos de acordo com a configuração eletrônica (ou seja, o número e a disposição de seus elétrons), seu comportamento químico, sua solubilidade, ou sua ocorrência em depósitos geológicos. Hoje é amplamente aceito que os elementos químicos devem ser organizados de acordo com seu número atômico e divididos em grupos de acordo com sua configuração eletrônica. Mas mesmo para esta tabela periódica, existem inúmeras formas diferentes de representação. Por exemplo:como uma espiral com várias protuberâncias, em forma de pirâmide, ou como uma flor tridimensional.
p
Uma estrutura comum por trás das tabelas periódicas
p Guillermo Restrepo e Wilmer Leal já investigaram sistematicamente a ambigüidade da tabela periódica. Isso levou a descobertas que também são de considerável importância além da química. De acordo, todas as formas de representação dos elementos químicos são baseadas em uma estrutura comum, ao qual os matemáticos se referem como um hipergrafo ordenado. A venerável tabela periódica de Mendeleev e Meyer, portanto, oferece apenas uma representação da estrutura geral, que Guillermo Restrepo e Wilmer Leal agora postulam. Novos arranjos também podem ser derivados disso a qualquer momento. Guillermo Restrepo compara, portanto, a ordem dos elementos químicos com uma escultura na qual a luz incide de diferentes direções. "As várias sombras que a figura projeta são as tabelas periódicas. É por isso que existem tantas maneiras de criar essas tabelas. De certa forma, as tabelas de período são projeções. Projeções da estrutura interna da tabela periódica. "
p Os cientistas de Leipzig estão agora tentando determinar a estrutura matemática oculta na qual as tabelas periódicas conhecidas da química se baseiam. Por enquanto, eles definiram três condições que devem ser atendidas para estabelecer uma tabela periódica. Primeiro, são necessários objetos que devem ser encomendados. Para Mendeleev, Meyer e os criadores das outras tabelas periódicas conhecidas da química, estes são os elementos químicos. These objects must be arranged according to some properties such as the atomic mass or the atomic number (i.e. the number of protons). Finalmente, one criterion is required to group the objects in classes. Mendeleev and Meyer used the chemical similarity for this.
 p A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, por exemplo, are more polarized than bonds of boron, fósforo, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Por exemplo, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
p A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, por exemplo, are more polarized than bonds of boron, fósforo, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Por exemplo, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
p
Periodic table of chemical bonds
p "If these three conditions are met, periodic tables can also be created for other chemical objects and even for objects outside chemistry, " says Guillermo Restrepo. He and Wilmer Leal show this by looking at the chemical bonds between atoms of 94 elements and different conjugates. The polarizability of 94 single-covalent bonds, where bonds are arranged according to the electronegativity and atomic radius of one of the bonded atoms. Por exemplo, flúor, chlorine, or oxygen are highly electronegative and assume relatively small atomic radii in compounds. The bonds are then classified based on how much they resemble each other.
p "We have investigated almost 5, 000 substances consisting of two elements in different proportions, " explains Guillermo Restrepo. "We then looked for similarities within this data. Por exemplo, sodium and lithium are similar because they combine with the same elements in the same proportions (e.g. with oxygen or chlorine, bromo, and iodine). We thus found patterns we can use to classify the elements."
p
A periodic table as a network instead of a matrix
p In the 44 classes of chemical elements, there are some similarities with the main groups of Mendeleev's and Meyer's periodic table. Por exemplo, the alkali metals sodium and lithium are found in one group because they form the same simple salts with halogens such as chlorine or fluorine. Like the elements themselves, the bonds of the four halogens (fluorine, chlorine bromine, and iodine) are also found in the same group. Contudo, there are also classifications that differ significantly from those in the conventional periodic table. Por exemplo, carbon and silicon are no longer in the same class because they form very different compounds.
p The representation of the periodic table of chemical bonds also has nothing to do with the familiar matrix-like arrangement of the classical periodic tables of the elements. Em vez de, the 94 covalent bonds are represented in a network of differently colored circles. Each circle represents a chemical bond, and the colou symbolizes belonging to one of the 44 groups. Because now two criteria are used for the sorting, there is no longer any clear order of the atoms (like in the tables of Mendeleev and Meyer)—mathematicians speak of a partial order. The circles are therefore connected to other circles by one or more arrows, thereby creating an ordered hypergraph.
p
Periodic tables in other scientific fields
p The chemical elements and their compounds can also be represented in completely different periodic tables—depending on the underlying order and classification principle. What's more:The objects of numerous other scientific fields and their applications can also be arranged in periodic tables. Por exemplo, ordered hypergraphs are used in information systems and web mining. Possible periodic systems also emerge when countries are considered; these can be classified according to social or economic indicators as well as geographical proximity or cultural similarity. Other examples can be found in engineering, environmental sciences, sociologia, and many other disciplines. The scientists not only study periodic systems because of their importance for chemistry, mas, sobre tudo, because of their applications in many other disciplines.

