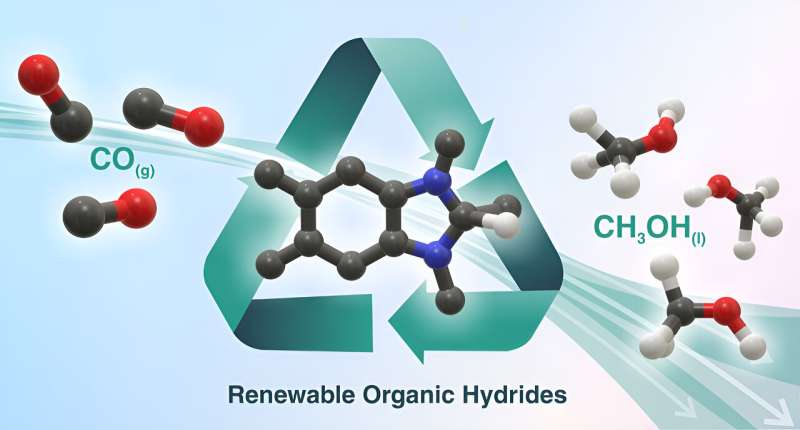
 Pesquisadores do Laboratório Nacional de Brookhaven e da Universidade da Carolina do Norte em Chapel Hill identificaram hidretos orgânicos renováveis que podem converter eficientemente monóxido de carbono (CO) em metanol (CH3 OH). Esses reagentes poderiam fazer parte de uma estratégia em cascata para converter dióxido de carbono atmosférico (CO2 ) em combustível líquido facilmente transportável/armazenável. Crédito:Andressa Muller/Laboratório Nacional Brookhaven
Pesquisadores do Laboratório Nacional de Brookhaven e da Universidade da Carolina do Norte em Chapel Hill identificaram hidretos orgânicos renováveis que podem converter eficientemente monóxido de carbono (CO) em metanol (CH3 OH). Esses reagentes poderiam fazer parte de uma estratégia em cascata para converter dióxido de carbono atmosférico (CO2 ) em combustível líquido facilmente transportável/armazenável. Crédito:Andressa Muller/Laboratório Nacional Brookhaven Cientistas do Laboratório Nacional Brookhaven do Departamento de Energia dos EUA (DOE) e da Universidade da Carolina do Norte Chapel Hill (UNC) demonstraram a conversão seletiva de dióxido de carbono (CO
2 ) em metanol usando uma estratégia de reação em cascata. O processo de duas partes é alimentado pela luz solar, ocorre à temperatura ambiente e à pressão ambiente e emprega um reagente orgânico reciclável semelhante a um catalisador encontrado na fotossíntese natural.
"Nossa abordagem é um passo importante para encontrar uma maneira eficiente de converter CO2 , um potente gás de efeito estufa que representa um desafio significativo para a humanidade, em um combustível líquido facilmente armazenável e transportável", disse o químico sênior do Brookhaven Lab, Javier Concepcion, principal autor do estudo.
A pesquisa foi conduzida como parte do Centro de Abordagens Híbridas em Energia Solar para Combustíveis Líquidos (CHASE), um Centro de Inovação Energética baseado na UNC. O estudo foi publicado como artigo de capa no Journal of the American Chemical Society .
A conversão de CO2 na temperatura ambiente em combustíveis líquidos tem sido uma busca de décadas. Tais estratégias poderiam ajudar a alcançar ciclos energéticos neutros em carbono, especialmente se a conversão for alimentada pela luz solar. O carbono emitido como CO2 através da queima de moléculas de combustível de carbono único, como o metanol, poderia essencialmente ser reciclado para a produção de novo combustível sem adicionar qualquer novo carbono à atmosfera.
Metanol (CH3 OH) é um alvo particularmente atraente porque é um líquido que pode ser facilmente transportado e armazenado. Além de sua utilidade como combustível, o metanol serve como matéria-prima essencial na indústria química para a produção de moléculas mais complexas. Além disso, como o metanol contém apenas um átomo de carbono, como o CO2 , evita a necessidade de fazer ligações carbono-carbono, que requerem processos que consomem muita energia.
No entanto, as principais etapas envolvidas nas reações necessárias para gerar de forma seletiva e eficiente combustíveis solares líquidos como o metanol permanecem pouco compreendidas.
"Convertendo CO2 ao metanol é muito difícil de conseguir em uma única etapa. É energeticamente semelhante a escalar uma montanha muito alta", disse Concepcion. "Mesmo que o vale do outro lado esteja em uma altitude mais baixa, chegar lá requer muita energia."
Em vez de tentar enfrentar o desafio em uma única “escalada”, a equipe de Brookhaven/UNC usou uma estratégia em cascata (múltiplas etapas) que passa por vários intermediários que são mais fáceis de alcançar.
“Imagine escalar várias montanhas menores em vez de uma grande – e fazê-lo através de vários vales”, disse Concepion.
 Primeira autora Andressa Muller medindo a cinética da reação usando espectroscopia infravermelha de fluxo interrompido. Crédito:Kevin Coughlin/Laboratório Nacional Brookhaven
Primeira autora Andressa Muller medindo a cinética da reação usando espectroscopia infravermelha de fluxo interrompido. Crédito:Kevin Coughlin/Laboratório Nacional Brookhaven
Os vales representam intermediários de reação. Mas mesmo chegar a esses vales pode ser difícil, exigindo a troca gradual de elétrons e prótons entre várias moléculas. Para reduzir os requisitos de energia dessas trocas, os químicos usam moléculas chamadas catalisadores.
“Os catalisadores permitem chegar ao próximo vale através de ‘túneis’ que requerem menos energia do que subir a montanha”, disse Concepcion.
Para este estudo, a equipe explorou reações empregando uma classe de catalisadores chamados diidrobenzimidazóis. Estes são hidretos orgânicos – moléculas que possuem dois elétrons extras e um próton para “doar” a outras moléculas. São baratos, suas propriedades podem ser facilmente manipuladas e estudos anteriores mostraram que podem ser reciclados, um requisito para um processo catalítico.
Essas moléculas são semelhantes em estrutura e função aos cofatores orgânicos responsáveis por transportar e distribuir energia na forma de elétrons e prótons durante a fotossíntese natural.
"A própria fotossíntese é uma cascata de muitas etapas de reação que convertem o CO2 atmosférico , água e energia luminosa em energia química na forma de carboidratos - ou seja, açúcares - que podem mais tarde ser metabolizados para alimentar a atividade dos organismos vivos. Nossa abordagem de usar hidretos orgânicos biomiméticos para catalisar o metanol como combustível líquido pode, portanto, ser vista como uma abordagem artificial para a fotossíntese", disse o co-autor principal da UNC, Renato Sampaio.
No estudo, os químicos quebraram a conversão de CO2 em metanol em duas etapas:redução fotoquímica de CO2 em monóxido de carbono (CO), seguido por transferências sequenciais de hidretos de diidrobenzimidazóis para converter o CO em metanol.
Seu trabalho descreve os detalhes da segunda etapa, à medida que a reação prossegue através de uma série de intermediários, incluindo um monóxido de carbono ligado ao rutênio (Ru-CO
2+
), um grupo rutênio formil (Ru-CHO
+
) fração, um hidroximetil rutênio (Ru-CH2 AH
+
) grupo e, finalmente, liberação de metanol induzida pela luz.
Embora as duas primeiras etapas deste esquema sejam "reações escuras", a terceira etapa que resulta em metanol livre é iniciada pela absorção de luz pelo rutênio hidroximetil (Ru-CH2 AH
+
) complexo. O mecanismo proposto pelo qual isso ocorre é através de uma transferência de elétrons no estado excitado entre o Ru-CH2 AH
+
e uma molécula de hidreto orgânico seguida rapidamente por uma transferência de prótons terrestres que resulta na geração de metanol em solução.
"A natureza 'única' e seletiva desta reação resulta na geração de concentrações milimolares (mM) de metanol - a mesma faixa de concentrações dos materiais de partida - e evita complicações que afetaram esforços anteriores para usar catalisadores inorgânicos para estes reações", disse o coautor da UNC e diretor do CHASE, Gerald Meyer. "Este trabalho pode, portanto, ser visto como um passo importante no uso de catalisadores de hidreto orgânico renovável para a busca de décadas pela produção de metanol catalítico em temperatura ambiente a partir de CO2 ."

