Dobramento rápido para peptídeos sintéticos e microproteínas
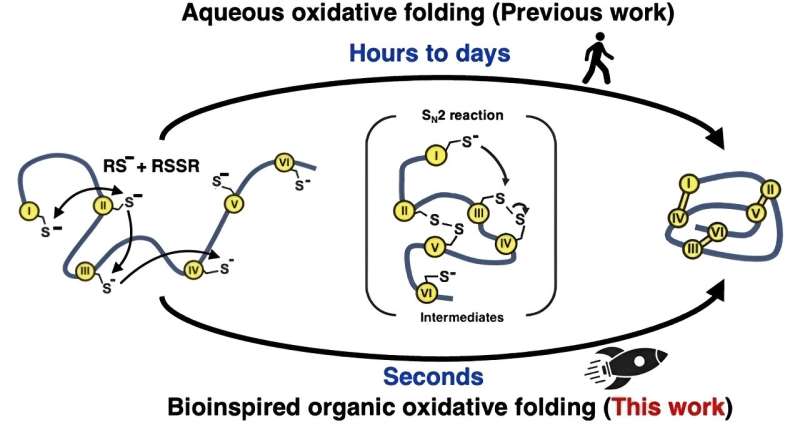 Um resumo esquemático do dobramento do peptídeo/microproteína criando a estrutura final mantida no lugar por ligações dissulfeto. Crédito:Dr. Kam e Dr. Loo (XJTLU)
Um resumo esquemático do dobramento do peptídeo/microproteína criando a estrutura final mantida no lugar por ligações dissulfeto. Crédito:Dr. Kam e Dr. Loo (XJTLU) Certos tipos de peptídeos e microproteínas para pesquisa de descoberta de medicamentos podem ser produzidos de forma mais eficiente e rápida usando um solvente de reação que ajuda a imitar o comportamento da natureza.
Os químicos podem agora produzir uma importante classe de pequenas proteínas chamadas peptídeos ricos em cisteína em sua estrutura 3D naturalmente dobrada de forma mais confiável e muito mais rápida, graças a métodos que imitam o que acontece dentro das células. O avanço, alcançado por pesquisadores da Universidade Xi'an Jiaotong-Liverpool (XJTLU), na China, e da Universidade Tecnológica de Nanyang (NTU), em Cingapura, foi publicado na revista Angewandte Chemie. .
A cisteína é uma das muitas moléculas diferentes de aminoácidos que podem ser ligadas entre si para formar cadeias de proteínas. Os peptídeos são cadeias mais curtas do que muitas proteínas naturais. Cada molécula de cisteína contém um átomo de enxofre que pode se ligar ao enxofre de outra cisteína em outra parte da proteína, mantendo juntas diferentes partes da cadeia.
“Recriar as formas 3D de peptídeos ricos em cisteína sempre foi um grande problema em sua fabricação”, diz o Dr. Shining Loo, da equipe XJTLU. Muitas proteínas e peptídeos bioativos possuem múltiplas ligações dissulfeto entre aminoácidos cisteína, que são cruciais para manter sua estrutura dobrada 3D precisa. Medicamentos como linaclotide para constipação e ziconotida para dor crônica são exemplos de medicamentos peptídicos ricos em cisteína no mercado.
“Nosso procedimento deve abrir novas oportunidades para a descoberta de medicamentos e a fabricação econômica de microproteínas e peptídeos ricos em cisteína como agentes terapêuticos”, acrescenta o pesquisador Dr. Antony Kam, da equipe XJTLU.
 Ligação dissulfeto comum em estruturas proteicas. Crédito:A7Davis (Domínio Público)
Ligação dissulfeto comum em estruturas proteicas. Crédito:A7Davis (Domínio Público)
Influência da natureza
Inspirados pela forma como a natureza dobra rapidamente as proteínas dentro das células, os pesquisadores tentaram uma abordagem diferente para as reações de dobramento “oxidativas” que formam as ligações dissulfeto. Em vez de usar soluções à base de água (aquosas), usaram uma mistura de solventes orgânicos. Este método imita a enzima natural que medeia a formação da ligação dissulfeto, criando um ambiente altamente reativo para acelerar bastante a formação e o rearranjo dessas ligações.
Ao aprender desta forma com a natureza, a equipe foi capaz de produzir 15 peptídeos e microproteínas diferentes, com entre 14 e 58 aminoácidos de comprimento e duas a cinco ligações dissulfeto, em taxas mais de 100.000 vezes mais rápidas do que poderiam ser alcançadas em solventes aquosos.
"O dobramento foi concluído com eficiência em um segundo", observa o Dr. Loo, "E a gama de microproteínas que produzimos demonstra que nosso método deve ser eficaz com uma gama muito maior de peptídeos e microproteínas em investigações futuras."
Esta descoberta é o mais recente avanço do grupo de pesquisa XPad (XJTLU Peptide and Drug), estabelecido conjuntamente pelo Dr. Loo e Dr. Kam. Este grupo está empenhado em utilizar ferramentas de biologia química, biologia sintética e farmacologia molecular para avançar na aplicação de peptídeos no desenvolvimento de agentes terapêuticos.
“O futuro da pesquisa de peptídeos é muito promissor e estamos comprometidos em fornecer avanços ainda mais valiosos neste campo”, conclui o Dr. Kam.

