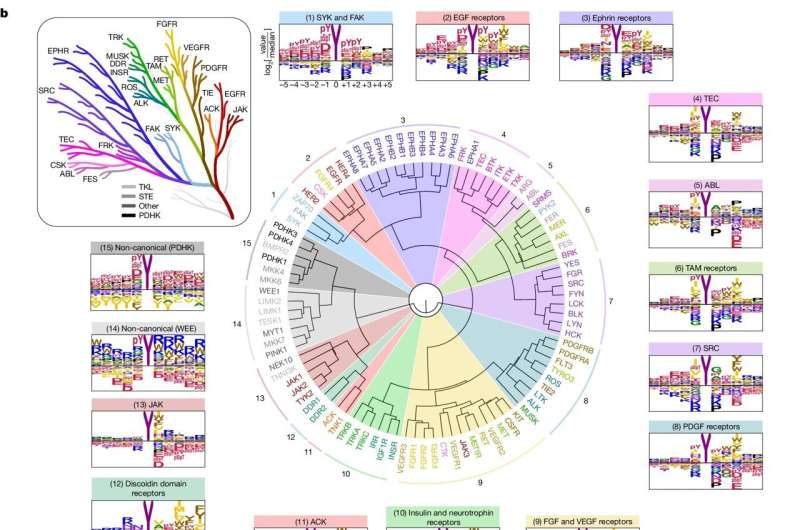
 O perfil dos motivos de fosforilação ideais revela a especificidade da sequência do kinoma Tyr humano. um , Fluxo de trabalho experimental para a análise PSPA e resultados representativos. Z denota posições fixas contendo um dos 20 aminoácidos naturais, Thr fosforilado (pT) ou Tyr fosforilado (pY). X indica posições não fixas contendo misturas aleatórias de aminoácidos totalmente naturais, exceto Tyr e Cys. Os autorradiogramas (à direita) indicam preferências de quinase para aminoácidos específicos em cada posição; manchas mais escuras indicam resíduos preferidos. b , Agrupamento hierárquico de 93 Tyr quinases com base na sua seletividade ao motivo de aminoácidos determinada a partir dos dados quantificados de PSPA. Os nomes das quinases são codificados por cores de acordo com a filogenia da sequência do domínio catalítico (inserção). Crédito:Natureza (2024). DOI:10.1038/s41586-024-07407-y
O perfil dos motivos de fosforilação ideais revela a especificidade da sequência do kinoma Tyr humano. um , Fluxo de trabalho experimental para a análise PSPA e resultados representativos. Z denota posições fixas contendo um dos 20 aminoácidos naturais, Thr fosforilado (pT) ou Tyr fosforilado (pY). X indica posições não fixas contendo misturas aleatórias de aminoácidos totalmente naturais, exceto Tyr e Cys. Os autorradiogramas (à direita) indicam preferências de quinase para aminoácidos específicos em cada posição; manchas mais escuras indicam resíduos preferidos. b , Agrupamento hierárquico de 93 Tyr quinases com base na sua seletividade ao motivo de aminoácidos determinada a partir dos dados quantificados de PSPA. Os nomes das quinases são codificados por cores de acordo com a filogenia da sequência do domínio catalítico (inserção). Crédito:Natureza (2024). DOI:10.1038/s41586-024-07407-y No corpo humano, moléculas conhecidas como quinases propagam sinais dentro e entre as células, retransmitindo sinais que permitem que as células respondam às mudanças no ambiente. No entanto, existem centenas de quinases diferentes no corpo, e identificar as suas funções individuais e colectivas é um desafio.
Num novo estudo, o farmacologista de Yale, Benjamin Turk, e os seus colegas desenvolveram ferramentas que podem ajudar os investigadores a aprofundar os papéis das cinases individuais e a começar a descobrir uma imagem mais completa da sua contribuição colectiva para a função biológica.
E como as quinases disfuncionais estão frequentemente implicadas no cancro, uma compreensão mais refinada da sua função pode produzir melhores tratamentos no futuro, dizem eles.
As descobertas foram publicadas na Nature .
Quinases são enzimas que facilitam um processo chamado fosforilação. Nos casos que envolvem proteínas, uma proteína quinase recruta um pedaço de uma molécula chamada grupo fosfato (um fragmento molecular que consiste em um átomo de fósforo e quatro átomos de oxigênio) e ajuda a fixá-lo a uma área específica de uma proteína conhecida como local de fosforilação. Isto pode alterar a função da proteína de várias maneiras, alterando a sua atividade ou o local para onde ela viaja, por exemplo.
Existem dois tipos de proteínas quinases, dependendo das proteínas que fosforilam:serina/treonina quinases, nas quais Turk se concentrou em um estudo anterior, e tirosina quinases, objeto do novo estudo.
“As tirosina quinases, em particular, são realmente importantes para a comunicação célula a célula e órgão a órgão”, disse Turk, professor associado de farmacologia na Escola de Medicina de Yale. "A principal classe de tirosina quinases está associada a fatores de crescimento. Compreender como as tirosina quinases sinalizam é a chave para entender como as células se comunicam entre si, sendo essa comunicação muitas vezes um sinal para crescer ou se dividir."
Todos os tipos de tirosina quinases – das quais existem 78 em humanos – tendem a enviar sinais de crescimento excessivos quando se tornam hiperativados, o que é um evento chave no crescimento do tumor, diz Turk.
“Este tipo de estudo nos ajuda a compreender a organização da sinalização da tirosina quinase, o que nos dá uma ideia de como as quinases enviam sinais de crescimento e como o bloqueio das quinases pode levar a uma resposta terapêutica”, disse ele.
Para o estudo, os pesquisadores analisaram primeiro como as quinases reconhecem seus alvos. As proteínas são constituídas por aminoácidos, dos quais existem 20; as quinases reconhecem cadeias curtas de aminoácidos que circundam o local que fosforilam.
Especificamente, os pesquisadores distribuíram cada uma das 78 tirosina quinases em poços individuais de placas de laboratório, misturaram-nas com um grande número de cadeias de aminoácidos diferentes e depois observaram quais cadeias as quinases preferiam fosforilar. Eles então compararam as cadeias preferidas das quinases com as proteínas do corpo humano.
“E aprendemos algumas coisas fazendo isso”, disse Turk.
Em primeiro lugar, poderiam, até certo ponto, começar a combinar as quinases com os seus alvos no corpo, o que dá aos investigadores informações sobre o papel específico de uma determinada quinase.
Talvez mais importante ainda, as suas descobertas permitiram-lhes descobrir algumas das regras mais amplas da atividade da tirosina quinase. Foi como se eles começassem a ver a fiação de uma casa, e não apenas onde estavam as tomadas individuais, disse Turk.
Uma dessas regras tem a ver com a forma como as tirosina quinases recrutam quinases adicionais para propagar uma cascata de sinalização. Outra envolve como os aminoácidos que cercam um local de fosforilação determinam não apenas onde a fosforilação ocorrerá, mas também a taxa em que ela ocorre.
E, o que é importante para o desenvolvimento do tratamento, as ferramentas desenvolvidas neste estudo permitem aos investigadores inferir quais quinases podem estar activas numa célula ou tecido num determinado momento e como perturbá-las pode afectar a sua função.
“Podemos usar drogas para inibir quinases individuais e, quando fazemos isso, podemos ver a atividade dessa quinase diminuir”, disse Turk. “E os inibidores da tirosina quinase são um dos principais tratamentos direcionados ao câncer. Mas as células cancerosas podem se adaptar a esse tipo de terapia e tornar-se resistentes a ela, causando recaídas nos pacientes”.
Com as suas ferramentas, os investigadores podem observar como o bloqueio de uma quinase com um inibidor por vezes leva à sobreativação de outras quinases, o que pode explicar como as células cancerígenas se adaptam e continuam a crescer. E isso pode ajudar os investigadores a desenvolver terapias mais eficazes, disse Turk.
No futuro, Turk pretende usar as regras descobertas neste trabalho para começar a separar os principais processos biológicos e analisar mais detalhadamente como diferentes células respondem a vários inibidores de quinase.
Mas há outra conclusão importante deste trabalho para ele.
As tirosina quinases são mais recentes, evolutivamente falando, do que outras quinases, surgindo com organismos multicelulares. Quando Turk e seus colegas compararam as tirosina quinases humanas com as dos nematóides - um tipo de verme do qual o ramo humano da árvore evolutiva divergiu há milhões de anos - a especificidade de ambos os grupos de quinases, ou quão específicos eles são em relação aos seus alvos, eram extremamente semelhantes.
“Isso diz que esta especificidade – e a compreensão de como ela ocorre – é realmente importante”, disse Turk. “Ele foi conservado ao longo de milhões de anos de evolução, e a natureza não o teria mantido com tantos detalhes sem razão”.
