 Crédito:Journal of Medicinal Chemistry (2024). DOI:10.1021/acs.jmedchem.3c02382
Crédito:Journal of Medicinal Chemistry (2024). DOI:10.1021/acs.jmedchem.3c02382 Um número crescente de bactérias tornou-se resistente a muitos antibióticos comumente usados. Pesquisadores de Bochum descobriram uma nova oportunidade para uma potencial molécula ativa cujo antecessor foi rejeitado. Ao estudar a sua interação com a proteína alvo bacteriana com muita precisão em três dimensões, eles identificaram um ponto de ataque anteriormente não detectado que poderia ser alvo deste composto.
“Como esse ponto de ataque ocorre apenas em proteínas bacterianas, o medicamento se tornaria muito mais seletivo e sua nocividade às células humanas seria reduzida”, explica o professor Raphael Stoll, chefe do grupo de pesquisa de Espectroscopia de RMN Biomolecular da Faculdade de Química e Bioquímica. na Ruhr University Bochum, Alemanha.
Os pesquisadores publicaram suas descobertas em 4 de abril de 2024, no Journal of Medicinal Chemistry .
Tentativas significativas há 20 anos
O estudo se concentrou na proteína peptídeo deformilase (PDF). Envolvido nos processos de maturação de proteínas nas células, o PDF é essencial para a sobrevivência das bactérias. No entanto, é encontrado tanto em bactérias quanto em células humanas. “Há cerca de 20 anos, foram feitas tentativas significativas para combater a PDF com agentes antibióticos”, salienta Stoll.
"No entanto, o medicamento candidato original, a actinonina, teve que ser descartado por vários motivos. Um dos problemas enfrentados foi o recém-descoberto PDF humano, que estava potencialmente associado a efeitos colaterais. Ainda assim, foram realizadas mais pesquisas para gerar compostos ativos modificados. ”, acrescenta Hendrik Kirschner.
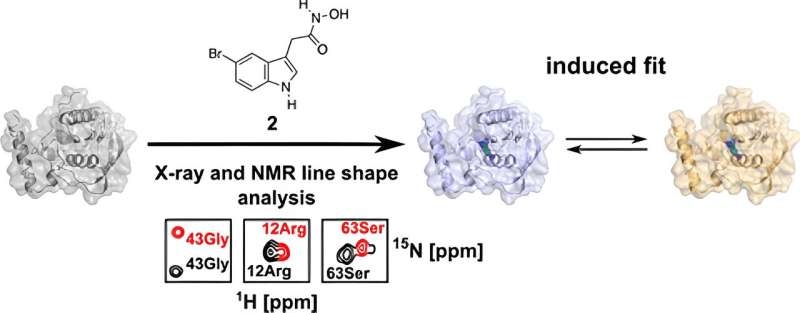
Como parte de sua tese de doutorado, ele examinou detalhadamente o PDF no presente estudo e o analisou da perspectiva da biologia estrutural usando espectroscopia de ressonância magnética nuclear (RMN) biomolecular e cristalografia de raios X. Estas técnicas permitiram-lhe obter uma estrutura 3D resolvida ao mais ínfimo detalhe.
“Este é o resultado de muitos anos de colaboração com o nosso colega Professor Eckhard Hofmann”, diz Stoll.
Molécula ativa é adaptada e tornada mais seletiva
“Podemos usar essas técnicas para visualizar superfícies e bolsas de ligação de biomoléculas e mostrar que a ligação da molécula a essa proteína não é estática, mas dinâmica”, explica Kirschner.
Os pesquisadores notaram que existem duas orientações de ligação diferentes na proteína para uma molécula de medicamento modificada:além da orientação que também está presente no PDF humano, há outra que deveria, em princípio, ocorrer exclusivamente no PDF bacteriano.
“Isso nos leva a modificar a molécula do medicamento para que favoreça a segunda orientação de ligação”, diz Stoll.
Como resultado, a molécula do antibiótico poderia tornar-se mais selectiva. “Isso poderia proporcionar uma segunda chance a este candidato a medicamento”, conclui Kirschner.
