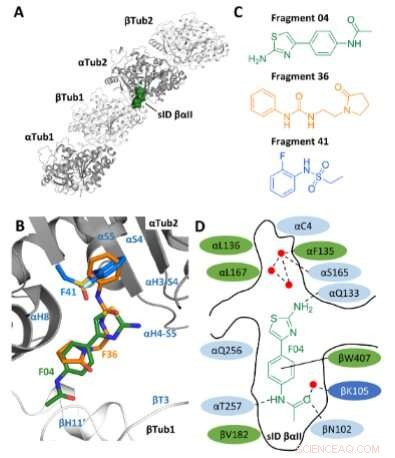
Seleção de fragmentos. A) Localização do site sID βαII (representação do volume) na interface interdímero βTub1-αTub2 do T2 complexo R-TTL. Por simplicidade, as cadeias RB3 e TTL não são mostradas. Os dois monômeros α- e dois β-tubulina no T2 O complexo R-TTL é mostrado na representação de fita cinza e branca, respectivamente. B) Sobreposição das poses de ligação F04, F36 e F41 (PDB IDs 5S4O, 5S5K e 5S5P, respectivamente). Os elementos da estrutura secundária da tubulina estão marcados em azul. Os átomos de carbono são coloridos em verde para F04, laranja para o fragmento F36 e azul claro para o fragmento F41. Os átomos de nitrogênio são coloridos em azul, os átomos de oxigênio em vermelho, os átomos de enxofre em amarelo e os átomos de flúor em verde claro. C) Estruturas químicas dos fragmentos F04, F36 e F41. D) Representação esquemática de F04 ligado ao sítio sID βαII. Os resíduos que formam o sítio de ligação são mostrados em verde para hidrofóbicos, em azul claro para polares e em azul escuro para resíduos carregados. Os resíduos de interação αL242 e αL252 não são mostrados porque estão localizados abaixo do ligante. As ligações de hidrogênio são indicadas com interações tracejadas e de empilhamento π com linhas pretas sólidas. Os pontos vermelhos representam moléculas de água cristalográficas. Crédito:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202204052
Pesquisadores do Instituto Paul Scherrer PSI e do Instituto Italiano de Tecnologia IIT desenvolveram uma nova substância que desativa uma proteína no esqueleto celular, levando à morte celular. Desta forma, substâncias deste tipo podem prevenir, por exemplo, o crescimento de tumores. Para conseguir isso, os pesquisadores combinaram um método biológico estrutural com o design computacional de agentes ativos. O estudo foi publicado na revista
Angewandte Chemie International Edition .
O esqueleto celular, também chamado de citoesqueleto, permeia todas as nossas células como uma rede dinâmica de estruturas proteicas semelhantes a fios. Dá às células sua forma, auxilia no transporte de proteínas e componentes celulares maiores e desempenha um papel crucial na divisão celular. O bloco de construção central é a proteína tubulina. Ele se organiza em estruturas em forma de tubo, os filamentos de microtúbulos.
Os agentes ativos que se ligam ao esqueleto celular estão entre os medicamentos mais eficazes contra o câncer. Eles bloqueiam a tubulina e, assim, impedem a divisão celular em tumores. Pesquisadores da PSI, em colaboração com o Instituto Italiano de Tecnologia em Gênova, desenvolveram agora outra substância potente que desativa a tubulina. Eles o apelidaram de "Todalam".
"Todalam impede que a tubulina se organize na forma de filamentos de microtúbulos", explica o primeiro autor Tobias Mühlethaler, que co-projetou e estudou a substância como parte de sua pesquisa de doutorado no PSI. "A proteína permanece como se estivesse congelada em uma estrutura que não cabe nos microtúbulos."
Projetado racionalmente Normalmente, existem duas abordagens diferentes para o desenvolvimento de novos medicamentos:os pesquisadores podem testar um número enorme de moléculas para descobrir aquelas que parecem promissoras ou podem projetar especificamente moléculas químicas que atinjam o efeito desejado. Os pesquisadores do PSI e do IIT escolheram o segundo caminho, que costuma ser mais difícil.
Ao fazer isso, eles foram capazes de construir em suas próprias bases, pesquisas em que já haviam localizado lugares na tubulina onde as moléculas podem se ancorar especialmente bem. São os chamados bolsões de ligação, dos quais foram encontrados 27. Além disso, os pesquisadores identificaram 56 fragmentos que se ligam a esses locais. Este trabalho também foi publicado anteriormente na
Angewandte Chemie International Edition .
No estudo atual com base neste trabalho anterior, os pesquisadores inicialmente selecionaram uma bolsa de ligação recém-descoberta na tubulina. Eles usaram o design computacional para combinar as estruturas de três fragmentos moleculares, que se ancoram preferencialmente neste ponto, em um único composto químico, e então o sintetizaram em laboratório. "Ao combinar os três fragmentos em uma molécula, esperávamos aumentar o efeito, já que a nova molécula preenche melhor a bolsa de ligação", diz Michel Steinmetz, chefe do Laboratório de Pesquisa Biomolecular do PSI.
Usando medições no Swiss Light Source SLS, os pesquisadores verificaram o quão bem a molécula realmente se encaixa no bolso de ligação. Em mais dois ciclos, melhoraram a substância até chegarem a Todalam. "Com uma química relativamente simples, conseguimos chegar a um composto potente", diz orgulhosamente Andrea Prota, cientista do grupo Steinmetz que colaborou de perto com Mühlethaler.
Estrutura química simples Em culturas de células, os pesquisadores demonstraram que Todalam mata células. Não admira, uma vez que a tubulina é essencial para a vida. "Quanto melhor uma substância se liga a um local crítico na tubulina, mais tóxica ela é para as células", explica Steinmetz. Isso faz do Todalam um ponto de partida promissor para o desenvolvimento de uma droga.
Os inibidores do citoesqueleto atualmente em uso clínico são substâncias naturais com estruturas grandes e complexas e, portanto, difíceis de sintetizar. O composto recém-desenvolvido Todalam, por outro lado, pode ser produzido em uma simples síntese química em laboratório. "Isso também significa que o composto pode ser produzido em grandes quantidades com relativa facilidade", enfatiza Steinmetz.
+ Explorar mais Citoesqueleto celular como alvo para novos agentes ativos
