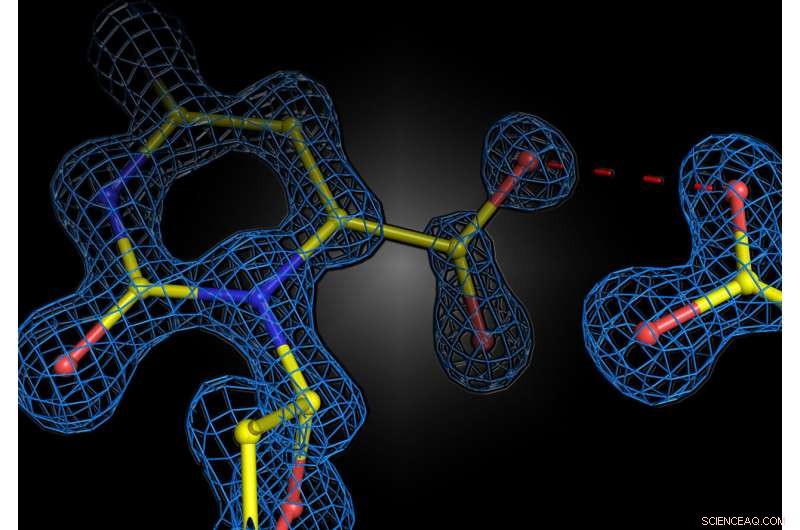
Instantâneo estrutural da reação enzimática na enzima humana orotidina 5'-fosfato descarboxilase. As duas cargas negativas do substrato e da enzima não se repelem, mas formam uma interação atrativa. Crédito:Kai Tittmann
É bem conhecido em física e química que cargas iguais se repelem, enquanto cargas opostas se atraem. Há muito se supunha que esse princípio também se aplicava quando as enzimas — os catalisadores biológicos em todos os organismos vivos — formam ou quebram ligações químicas. Pensava-se que as enzimas colocam cargas em seus "centros ativos", onde as reações químicas realmente ocorrem, de tal forma que repelem cargas semelhantes das outras moléculas ao seu redor. Este conceito é conhecido como "estresse eletrostático". Por exemplo, se o substrato (a substância sobre a qual a enzima atua) carrega uma carga negativa, a enzima pode usar uma carga negativa para "stressar" o substrato e assim facilitar a reação. No entanto, um novo estudo da Universidade de Göttingen e do Instituto Max Planck de Ciências Multidisciplinares em Göttingen mostrou agora que, ao contrário das expectativas, duas cargas iguais não levam necessariamente à repulsão, mas podem causar atração nas enzimas. Os resultados foram publicados na revista
Nature Catalysis .
A equipe investigou uma enzima bem conhecida que foi estudada extensivamente e é um exemplo clássico de catálise enzimática. Sem a enzima, a reação é extremamente lenta:na verdade, levaria 78 milhões de anos para metade do substrato reagir. A enzima acelera essa reação em 10
17
vezes, simplesmente posicionando cargas negativas e positivas no centro ativo. Como o substrato contém um grupo carregado negativamente que é dividido como dióxido de carbono, foi assumido por décadas que as cargas negativas da enzima serviam para estressar o substrato, que também é carregado negativamente, e acelerar a reação. No entanto, esse mecanismo hipotético permaneceu sem comprovação porque a estrutura da reação foi muito rápida para ser observada.
O grupo do professor Kai Tittmann no Centro de Göttingen para Biociências Moleculares (GZMB) conseguiu agora pela primeira vez usar cristalografia de proteínas para obter um instantâneo estrutural do substrato pouco antes da reação química. Inesperadamente, as cargas negativas da enzima e do substrato não se repeliram. Em vez disso, eles compartilharam um próton, que agiu como uma espécie de cola molecular em uma interação atraente. “A questão de saber se duas cargas iguais são amigas ou inimigas no contexto da catálise enzimática há muito é controversa em nosso campo, e nosso estudo mostra que os princípios básicos de como as enzimas funcionam ainda estão longe de serem compreendidos”, diz Tittmann. . As estruturas cristalográficas foram analisadas pelo químico quântico Professor Ricardo Mata e sua equipe do Instituto de Físico-Química da Universidade de Göttingen. "O próton adicional, que tem carga positiva, entre as duas cargas negativas não serve apenas para atrair a molécula envolvida na reação, mas desencadeia uma cascata de reações de transferência de prótons que aceleram ainda mais a reação", explica Mata.
"Acreditamos que esses princípios recém-descritos de catálise enzimática ajudarão no desenvolvimento de novos catalisadores químicos", diz Tittmann. “Como a enzima que estudamos libera dióxido de carbono, o gás de efeito estufa mais importante produzido pelas atividades humanas, nossos resultados podem ajudar a desenvolver novas estratégias químicas para a fixação do dióxido de carbono”.
+ Explorar mais Catalisadores enzimáticos híbridos sintetizados por uma abordagem de novo para expandir a biocatálise
