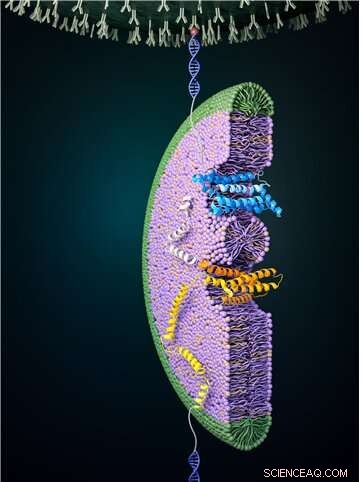
Figura 1:O processo de dobramento de um transportador de glicose usando pinças magnéticas. Uma força alta é aplicada primeiro para desenrolar a proteína completamente. A força aplicada é então abaixada, o que permite que o processo de dobramento seja observado. Na foto, uma porção do transportador de glicose pode ser vista sendo dobrada para formar uma estrutura e entrar na bicela (de cor azul). Esse processo de dobramento geralmente não ocorre sem assistência externa, portanto, esse processo é realizado com a ajuda do ambiente da membrana circundante e de complexos proteicos, como o EMC. Crédito:Universidade Nacional de Seul
As células são compartimentadas por membranas, e as proteínas presentes nestas membranas desempenham um papel importante no transporte de informações celulares. Para que ocorra o funcionamento adequado dessas proteínas, uma estrutura proteica terciária deve ser formada através do processo de dobramento correto. Em um estudo publicado na
Nature Chemical Biology , o processo de dobramento de um transportador de glicose - uma proteína de membrana complexa - foi identificado pela primeira vez usando pinças magnéticas de molécula única.
Utilizando o complexo proteico de membrana (EMC) do retículo endoplasmático (ER) e uma molécula lipídica com estrutura específica, a via de dobramento de um transportador de glicose foi totalmente elucidada em um ambiente fisiológico. Através da bioinformática, descobriu-se também que a capacidade de formação de estrutura da proteína de membrana e sua capacidade de transportar glicose tiveram que ter atingido um equilíbrio ao longo de sua história evolutiva.
Embora as estruturas de muitas proteínas de membrana - incluindo transportadores de glicose - já tenham sido reveladas por meio de avanços recentes na biologia estrutural, como a microscopia crioeletrônica, a via de dobramento na qual as estruturas dessas proteínas de membrana são formadas permanece quase completamente desconhecida. Em 2019, a equipe de pesquisa relatou em
Science que as vias de dobramento de proteínas de membrana podem ser reveladas usando pinças magnéticas, marcando a primeira vez no mundo que a via de dobramento de uma proteína de membrana foi revelada.
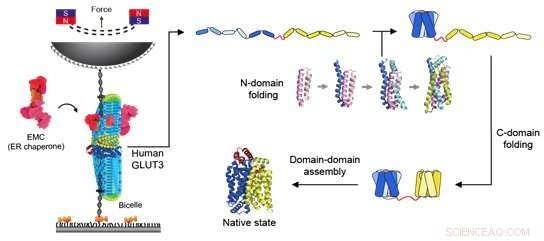
Figura 2:Diagrama esquemático de pinças magnéticas e a via de dobramento de um transportador de glicose. A esquerda mostra a aplicação de força ao transportador de glicose usando pinças magnéticas. Bicelles compostas de várias moléculas lipídicas foram fornecidas para fornecer um ambiente necessário para as proteínas de membrana funcionarem. Além disso, EMCs foram adicionados para ajudar a formar a estrutura correta da proteína terciária. Quando a esfera magnética é puxada em direção ao ímã permanente, a tensão é aplicada à corda de DNA conectada à proteína e uma força constante é aplicada à própria proteína. Através deste experimento, a via de dobramento do transportador de glicose foi revelada como mostrado no lado direito da figura. No estado totalmente desdobrado de proteínas de hélice individuais, o domínio N próximo ao terminal N é primeiro dobrado para obter a capacidade de formação de estrutura da proteína. Então, com a ajuda do EMC e uma molécula de lipídio de formato único, o domínio C se dobra e, finalmente, os dois domínios se combinam para formar uma estrutura proteica terciária funcional. Crédito:Universidade Nacional de Seul
Pinças magnéticas podem ser usadas para aplicar força a uma única proteína, desdobrando completamente a estrutura de uma proteína. Além disso, se a força aplicada for reduzida, é possível observar o processo da proteína liberada se redobrando de volta à sua forma original dobrada (Figura 1,2).
As proteínas transportadoras de glicose, como o nome sugere, são um grupo de proteínas que possuem uma via pela qual a glicose pode passar. As vias de transporte de glicose são funcionalmente essenciais, mas essas vias também atuam como obstáculos na formação das estruturas terciárias das proteínas de membrana. As células têm vários ajudantes para resolver essas dificuldades. Neste estudo, descobriu-se que a EMC – um tipo de proteína chaperona – bem como moléculas lipídicas de estrutura única trabalham em conjunto para ajudar o transportador de glicose na formação de sua estrutura.
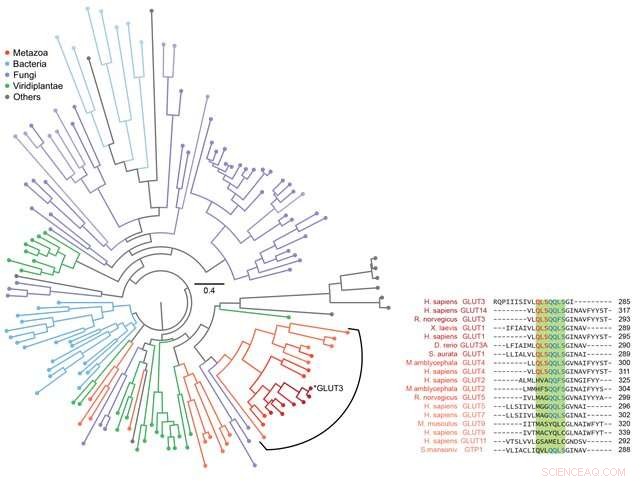
Figura 3:Análise filogenética para vários transportadores de açúcar. A bioinformática foi usada para analisar a sequência de GLUT3, bem como outras proteínas de transporte de açúcar relacionadas evolutivamente. Um total de 143 proteínas foram analisadas e apresentadas como uma árvore filogenética conforme mostrado na figura à esquerda. A sequência da proteína de transporte de açúcar dos metazoários, incluindo o Homo sapiens, foi analisada de perto, conforme mostrado à direita. Ao combinar esses dados com as informações observadas sobre a via de dobramento obtida por meio de pinças magnéticas, foi revelado que a capacidade de formação de estrutura das proteínas de membrana e sua capacidade de transportar açúcares efetivamente se desenvolveram por meio de um equilíbrio evolutivo. Crédito:Universidade Nacional de Seul
Especificamente, foi confirmado que o domínio correspondente a metade das proteínas transportadoras de glicose localizadas no N-terminal continha formações de estrutura mais estáveis em comparação com as proteínas do domínio C-terminal subsequente (Figura 2). Usando bioinformática, essa característica das proteínas transportadoras de glicose foi conservada em todas as proteínas transportadoras de açúcar de metazoários (Figura 3). Por meio dessas observações, pode-se concluir que a célula teve que encontrar um equilíbrio em sua estrutura, sacrificando parte de sua capacidade de formação de estrutura para obter proteínas de membrana funcionalmente superiores, desenvolvendo chaperonas altamente funcionais ou moléculas lipídicas estruturadas de forma única.
+ Explorar mais Laboratório encontra novos níveis de detalhes sobre as principais proteínas de membrana


