Pesquisadores descobrem a base molecular do processamento de antígeno para o câncer alvo MR1
Resumo gráfico. Crédito:Biologia Química da Natureza (2022). DOI:10.1038/s41589-022-01049-9
Em um novo estudo publicado na
Nature Chemical Biology , pesquisadores do Hospital Infantil da Filadélfia (CHOP) revelaram a mecânica molecular de uma molécula da superfície celular que é um alvo potencial de imunoterapia. Usando técnicas sofisticadas, incluindo espectroscopia de ressonância magnética nuclear (RMN), os pesquisadores demonstraram a importância das chamadas moléculas chaperonas na estabilização desse alvo, conhecido como proteína 1 relacionada ao MHC-I (MR1).
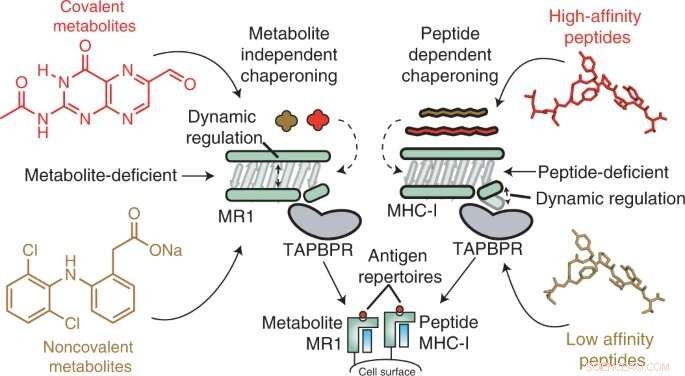
As moléculas do complexo principal de histocompatibilidade classe I (MHC-I) vivem na superfície de quase todas as células e apresentam antígenos peptídicos ao sistema imunológico, de modo que as células imunes podem detectar quando um antígeno estranho está presente, como bactérias, vírus ou mesmo desenvolver tumores. Em um processo semelhante, a proteína 1 relacionada ao MHC-I (MR1) apresenta metabólitos menores em sua superfície para vigilância por células imunes específicas de MR1, ou seja, células T invariantes associadas à mucosa (MAIT).
O MR1 é conhecido por ser importante para o reconhecimento de infecções microbianas, a identificação de células cancerosas em oposição às saudáveis e a regulação de doenças autoimunes. Estudos recentes também sugerem que o MR1 pode exibir uma gama muito mais ampla de moléculas, incluindo metabólitos específicos do câncer, que podem servir como sensores internos para doenças. Além disso, o MR1 não varia na população humana, tornando-se um alvo promissor de imunoterapia. No entanto, antes deste estudo, a mecânica molecular do MR1 era desconhecida – especificamente, o papel das moléculas chaperonas no reconhecimento e estabilização das moléculas MR1.
Usando técnicas in vitro e em células, os pesquisadores descobriram que o MR1 opera de maneira diferente do MHC-I, particularmente quando se trata de carga molecular e afinidade pelas chaperonas moleculares Tapasin e TAPBPR. Enquanto o MHC-1 demonstrou uma alta afinidade por chaperonas moleculares quando vazio, mas baixa afinidade quando carregado com antígenos de apresentação, o MR1 interagiu em níveis igualmente baixos com TAPBPR, independentemente de estar carregado com metabólitos ou não. Apesar da curta vida útil do complexo, os pesquisadores usaram a RMN para determinar com sucesso sua estrutura 3D em um ambiente aquoso fisiologicamente relevante. Curiosamente, essas interações de baixa afinidade ainda permitiram que as chaperonas catalisassem o carregamento e a troca de moléculas de metabólitos diretamente na superfície do MR1.
"Nossos resultados fornecem uma base para a utilização de chaperonas moleculares para estabilizar as moléculas MR1 e permitir o carregamento e a apresentação de antígenos diretamente na superfície da célula", disse Nikolaos G. Sgourakis, Ph.D., Professor Associado do Centro de Medicina Computacional e Genômica. no Hospital Infantil da Filadélfia e autor sênior do estudo. "Pesquisas futuras devem rastrear bibliotecas de metabólitos para ver quais mostram alta afinidade para ligação a MR1. Os pesquisadores podem então considerar maneiras de aumentar a expressão de superfície de MR1, potencialmente promovendo interações MR1/chaperona mais estáveis por meio de várias abordagens, como o uso de pequenas moléculas ."
+ Explorar mais Estudo revela dinâmica de proteínas cruciais do sistema imunológico
