Comportamento inesperado observado em catalisadores eficientes para energia limpa
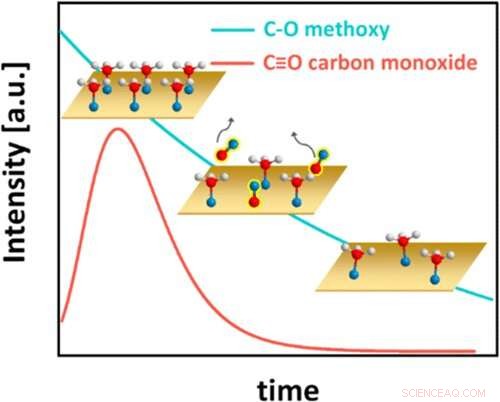
Resumo gráfico. Crédito:Catálise ACS (2022). DOI:10.1021/acscatal.1c05933
Pesquisadores do Instituto de Ciências Weizmann e do Laboratório Nacional Brookhaven do Departamento de Energia dos EUA (DOE) investigaram a dinâmica em nível molecular em jogo quando o metanol se converte em hidrogênio com a ajuda de um catalisador de cobre, com todo o sistema sob pressão e temperatura ambiente . Este estudo, que produziu algumas informações surpreendentes sobre o comportamento do metanol em diferentes superfícies de cobre, ajudará os pesquisadores a encontrar o catalisador de cobre com melhor desempenho para esse processo e, mais amplamente, aprofundar sua compreensão dos catalisadores de cobre como um grupo.
O metanol (um composto de hidrogênio, carbono e oxigênio) é um material versátil na indústria de energia. Ele pode ser usado como combustível ou, como nesta pesquisa, para produzir outro combustível:o hidrogênio. O metanol é um candidato líder para tecnologias de armazenamento de hidrogênio, particularmente em aplicações de células de combustível em automóveis. Um líquido à temperatura ambiente, é fácil de trabalhar e compatível com a infraestrutura de gasolina existente. Ele também contém uma quantidade relativamente grande de hidrogênio por volume. Mas para produzir hidrogênio com eficiência, o metanol requer a ajuda de um catalisador e uma temperatura relativamente alta.
Neste estudo, descrito na edição online de 14 de junho de 2022 do
ACS Catalysis , os pesquisadores de Weizmann e Brookhaven estudaram um sistema de metanol/cobre - vapor de metanol ligado, ou "adsorvido" em uma superfície de cobre - que não exigia alta temperatura. Eles se concentraram na "decomposição do metanol", a mais simples das quatro reações que podem produzir hidrogênio a partir do metanol. Dentre os possíveis catalisadores para a reação, os à base de cobre (Cu) são considerados os mais promissores. Isso se deve a vários fatores, incluindo sua estrutura eletrônica favorável à atividade catalítica e custo relativamente baixo e segurança ambiental em comparação com outros metais. Para entender melhor o papel do Cu, é essencial que os cientistas obtenham uma compreensão completa em nível molecular da interação entre o vapor de metanol e as superfícies de Cu.
Pesquisadores da Weizmann e do Centro de Nanomateriais Funcionais (CFN), uma instalação do DOE Office of Science User Facility em Brookhaven, analisaram três superfícies de Cu para aprender como o metanol aderiu a elas e como se comportou. Essas três geometrias de superfície são comumente investigadas como catalisadores devido à maneira como os átomos de Cu estão dispostos, o que os torna mais disponíveis para interagir eletronicamente com outros compostos. O grupo descobriu que o metanol age de maneiras inesperadas nas três superfícies.
"A tendência que vimos em todas as três superfícies foi que muito metanol foi adsorvido no início, depois se desfez em diferentes componentes que foram dessorvidos. Depois de algum tempo, a cobertura de metanol atingiu um ponto de equilíbrio", disse Ashley Head, pesquisador da Interface Grupo de Ciências/Catalysis do CFN e um dos autores do artigo. "Nós não tínhamos visto esse comportamento antes e não esperávamos."
Para estudar a dinâmica disso, o grupo utilizou técnicas de espectroscopia de infravermelho (IV) e de raios X, esta última realizada no CFN.
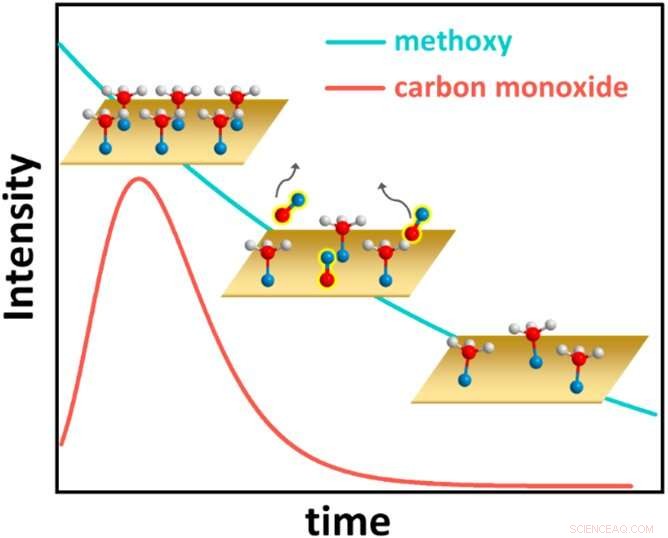
Esta figura mostra o comportamento cinético surpreendente do sistema metanol-cobre, com átomos de hidrogênio mostrados como esferas brancas, átomos de oxigênio como esferas azuis e átomos de carbono como esferas vermelhas. Inicialmente, o metanol cobre completamente a superfície do cobre (Cu) (gráfico superior esquerdo). Cada molécula de metanol então perde um átomo de hidrogênio e forma uma ligação química com o Cu, tornando-se uma espécie de carbono-oxigênio conhecida como metoxi. O metoxi da superfície, por sua vez, reage para formar monóxido de carbono (CO), que dessorve da superfície (gráfico central, com cobertura de CO ao longo do tempo representada pela linha vermelha). A cobertura de metoxi então diminui constantemente (gráfico inferior direito e linha azul). Eventualmente, uma cobertura de metoxi de equilíbrio é alcançada (não mostrada). Crédito:Laboratório Nacional de Brookhaven
O trabalho de IR, realizado em Weizmann, forneceu informações sobre quais espécies químicas de metanol se formaram na superfície do Cu medindo como as moléculas vibram. As vibrações específicas podem ser ligadas a compostos específicos.
Os dados de IR indicaram que o metanol adsorveu fortemente no cobre e formou uma ligação direta com o Cu, formando um componente químico conhecido como metoxi. A cobertura de metoxi então diminuiu gradualmente. Esse comportamento foi observado em todas as três superfícies, com pequenas variações.
“Essa dinâmica não concorda com o que modelos bem estabelecidos deste sistema nos dizem que devemos ver”, disse Baran Eren, pesquisador do Departamento de Física Química e Biológica de Weizmann e autor correspondente do artigo. "Em vez disso, a evolução da cobertura de metoxi com o tempo segue um modelo de cinética de adsorção extraordinário."
Ele continuou:"Nós propomos que uma forma de curta duração de metanol ligado ao hidrogênio é a fonte da camada metoxi densa inicial".
As informações obtidas a partir dos dados de IR foram confirmadas no CFN, onde o grupo utilizou espectroscopia de fotoelétrons de raios-X (APXPS). Nesta técnica, os raios X energizam os elétrons em uma amostra, fazendo com que eles se libertem. Esses elétrons ejetados carregam informações valiosas. Neste caso, eles forneceram informações adicionais sobre o comportamento do metanol na superfície do Cu e as condições ao redor, em tempo real. O APXPS permite que os pesquisadores calculem mais facilmente as coberturas de moléculas em superfícies do que a espectroscopia de infravermelho.
Com o passar do tempo, o excesso de metoxi foi eliminado à medida que mais e mais hidrogênio foi produzido, deixando monóxido de carbono que foi desassorvido do cobre como um gás. O metóxi que restava atingiu um ponto de cobertura uniforme — um ponto de equilíbrio. Notavelmente, a cinética deste processo foi consideravelmente mais rápida na superfície de Cu mais frouxamente empacotada em comparação com as outras duas, que são mais densamente empacotadas.
Em trabalhos futuros, o grupo planeja continuar estudando os sistemas metanol/Cu para aprender mais sobre sua dinâmica e se alguns desses comportamentos podem ser encontrados em outros sistemas além do metanol no Cu.
+ Explorar mais Apanhado em flagrante:identificados os principais intermediários químicos na reação do poluente ao combustível

