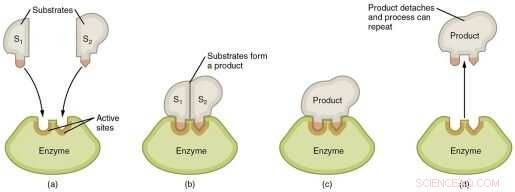
Representação gráfica das etapas de uma reação enzimática. Crédito:Wikimedia Commons
As enzimas encontradas nos organismos vivos têm um poder catalítico impressionante. Graças às enzimas, as reações químicas que sustentam a vida acontecem milhões de vezes mais rápido do que ocorreriam sem elas. As enzimas aceleram as reações ajudando a diminuir a energia de ativação necessária para iniciá-las, mas por mais de 70 anos, como as enzimas conseguem isso tem sido objeto de intenso debate.
O Dr. Tor Savidge, professor de patologia e imunologia do Baylor College of Medicine e do Texas Children's Microbiome Center, e seus colegas estão mudando a maneira de encarar esse velho argumento. Em seu trabalho publicado em
Chemical Science , eles investigaram as semelhanças e diferenças entre os dois mecanismos atualmente em debate, caracterizando reações catalíticas em um nível molecular detalhado.
"Atualmente, dois principais mecanismos de reação diferentes são propostos para explicar o poder catalítico enzimático", disse Savidge. "Uma propõe que as enzimas diminuam a energia de ativação da reação via estabilização dos estados de transição (TS) e a outra que o façam desestabilizando o estado fundamental (GS) das enzimas. A idéia atual é que esses mecanismos são mutuamente exclusivos."
O primeiro autor Dr. Deliang Chen da Gannan Normal University na China e seus colegas fizeram uma abordagem teórica, levando em consideração descobertas anteriores do laboratório Savidge mostrando que as interações não covalentes de substratos e enzimas com a água são importantes em termos do mecanismo da ação enzimática reações.
"Em um ambiente biológico, você tem que considerar a água - que ela vai interferir nas interações atômicas muito complexas que ocorrem no sítio ativo da enzima. Precisamos considerar todas elas para entender exatamente onde você precisa ter interações eletrostáticas que são vai favorecer esse processo enzimático", disse Savidge. "Quando você leva isso em consideração, você pode entender como esses mecanismos estão operando."
Suas análises levaram a equipe a propor algo novo:que TS e GS não são tão diferentes assim. Eles usam um mecanismo atômico semelhante para impulsionar a reação enzimática para a frente. O mecanismo envolve a água na alteração da carga de resíduos importantes dentro do sítio catalítico de forma a favorecer a formação de um estado energeticamente favorável que leva a reação enzimática a ocorrer.
"O ponto novo e importante aqui não é como isso é alcançado, mas quando é alcançado", disse Savidge. "Nós mostramos que na estabilização de estados de transição, as cargas que impulsionam a reação são formadas antes que o substrato entre no sítio ativo. Enquanto no estado fundamental de desestabilização isso também ocorre, mas depois que o substrato entra no sítio ativo."
Os pesquisadores também propuseram que o mecanismo comum entre TS e GS é universal; pode ser aplicado a muitas reações enzimáticas.
Suas descobertas têm implicações importantes não apenas para ajudar os pesquisadores a entender melhor o poder catalítico das enzimas, mas também para aplicações práticas de design de medicamentos.
"Usamos nossas descobertas para explorar mais profundamente a catálise enzimática microbiana em diferentes ambientes e para projetar enzimas artificiais", disse Savidge.
Yibao Li, Xun Li, Xiaolin Fan, da Gannan Normal University, e Xuechuan Hong, da Escola de Ciências Farmacêuticas da Universidade de Wuhan também contribuíram para este trabalho.
+ Explorar mais Mapeamento de campos elétricos para ajudar a desvendar como as enzimas funcionam
