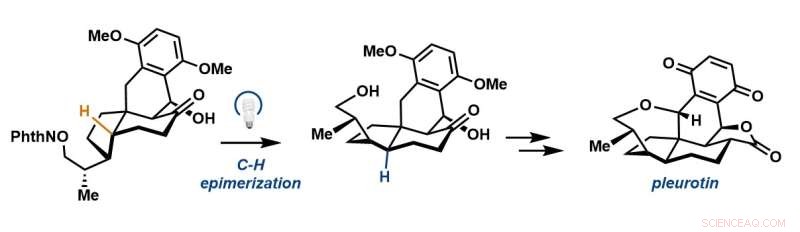
Uma epimerização radicalar fotoredox gera o esqueleto tetracíclico de pleurotina. Crédito:Laboratório Sorensen
Do ponto de vista dos químicos, a pleurotina é uma molécula intrigante.
Há fortes evidências de propriedades terapêuticas inexploradas como inibidor de tumor e antibiótico. Tem uma estrutura complexa fascinante (seis anéis! oito estereocentros!). E tem sido difícil sintetizar ao longo das décadas. A última vez que os químicos fizeram isso, o ano era 1988 e eles precisavam de 26 etapas para fazê-lo.
Para o Laboratório Sorensen da Princeton Chemistry, essas qualidades foram parte da atração para um investimento de longo prazo de tempo e energia que se concretizou.
O laboratório relata uma síntese concisa de pleurotina por meio da reação de Diels-Alder e uma epimerização radical que transforma um cis-hidrindano no trans-hidrindano desejado. Seu intermediário de estágio final cruza a síntese do marco de 1988 no final do processo, reduzindo assim o número total de etapas necessárias para a síntese em treze.
O processo do laboratório pode gerar uma família expandida de candidatos a exames anticancerígenos semelhantes à pleurotina que, no futuro, podem ser úteis para empresas farmacêuticas que desejam explorar a promessa da pleurotina como uma droga de próxima geração.
"A pleurotina é uma molécula muito sensível, é muito reativa. Mas ainda não funcionou como uma droga, em parte porque não é muito solúvel em água", disse John Hoskin, estudante do terceiro ano de pós-graduação, principal autor do artigo. "Idealmente, você quer alterar sua estrutura:ajustar aqui, mudar aqui, colocar um hidroxi aqui ou um fosfato ali, fazer algumas modificações muito cuidadosas."
"E como você não pode realmente fazer isso a partir da própria pleurotina, nossa abordagem será incorporar as mudanças a partir de uma síntese de base, o que só é possível devido à brevidade da rota. análogos que são muito semelhantes a este produto natural, mas que possuem essas mudanças estratégicas."
"A Concise Synthesis of Pleurotin Enabled by a Nontraditional C-H Epimerization" foi publicado no mês passado no
Journal of the American Chemical Society por Hoskin e P.I. Erik Sorensen, professor Arthur Allan Patchett de Química Orgânica no Departamento de Química.
"Quando um químico olha para uma estrutura como esta, não há estratégias óbvias que se deva tomar para criá-la a partir de compostos simples", disse Sorensen. Seu laboratório começou a trabalhar com pleurotina em 2008, apenas para se deparar com uma série de decepções. Até agora.
"Se você pegar pleurotina e disser, eu quero fazer química seletiva de sítio em sua periferia para que possamos construir novas moléculas com propriedades melhoradas, então talvez haja melhores agentes anticancerígenos", acrescentou. "Então John e eu fomos atraídos pelo desafio de desenvolver uma abordagem química para construir essa estrutura no menor número de etapas possível."
"Oito passos é um número muito pequeno de passos para uma molécula dessa complexidade", disse Sorensen. "Esta pesquisa é um testemunho da habilidade de John como designer e executor de síntese orgânica."
Promessa inexplorada desde 1947 A pleurotina deriva do fungo Pleurotus griseus. Os pesquisadores descreveram a molécula pela primeira vez em um artigo publicado em 1947 como inibindo o crescimento de Staphylococcus aureus, a fonte de infecções por estafilococos. Isso foi 41 anos antes da síntese marcante da pleurotina por David Hart, agora professor emérito da Ohio State University.
Mas devido à incapacidade de sintetizá-lo facilmente, a pleurotina não foi investigada em todo o seu potencial. Foi quando o Laboratório Sorensen interveio.
Para reduzir os passos em direção à síntese, os pesquisadores usaram uma tática testada e comprovada em síntese orgânica chamada transferência de átomo de 1,5 hidrogênio, na qual um radical reativo centrado no oxigênio essencialmente "estica a mão" e arranca um hidrogênio de um carbono que faz parte da estrutura da pleurotina para formar um novo radical. Os pesquisadores então usaram esse radical para receber hidrogênio de um tiol exógeno que permitiria que o estereocentro mudasse para uma configuração alternativa – ou trans.
"Tentamos muitas estratégias diferentes e, finalmente, o que acabou funcionando foi esse passo de inversão para passar deste cis-hidrindano para o trans-hidrindano. Essa é a visão principal", disse Hoskin. "Ao utilizar a funcionalidade inerente à molécula - esse oxigênio - poderíamos, como se estivéssemos usando um par de pinças microscópicas, arrancar esse hidrogênio e virar esse carbono para obter o trans-hidrindano necessário".
O processo gera um produto final racêmico, tornando as versões direita e esquerda em proporções iguais. Apenas um deles é susceptível de ser bioativo. Agora que a síntese formal foi concluída de forma mais concisa, disse Hoskin, o próximo desafio será produzir apenas uma versão espelhada da molécula e seus análogos.
"Esta pesquisa mostra o poder de uma breve síntese", disse Hoskin. "Leva apenas uma semana para percorrer todo o caminho."
Sorensen acrescentou:"Acho que este trabalho nos coloca em uma posição favorável em relação ao nosso objetivo mais amplo de expandir a classe de agentes anticancerígenos à base de pleurotina".
+ Explorar mais A reversão acelera a criação de uma molécula importante:o laboratório torna a síntese da halicondrina B mais eficiente
