Pesquisadores determinam o mecanismo de ativação de receptores acoplados à proteína G
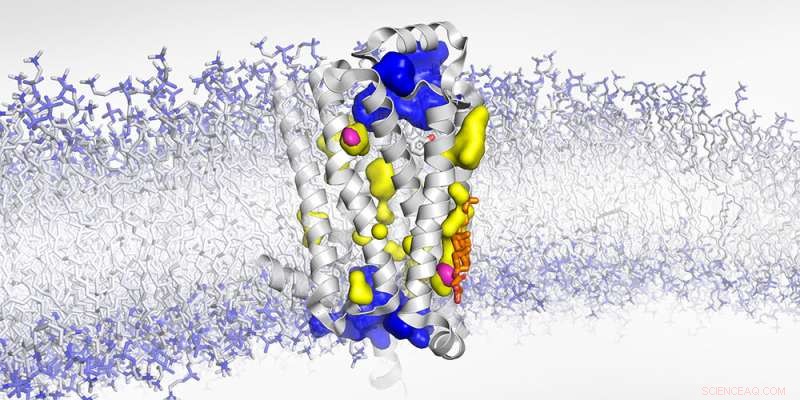
Estrutura do receptor β1-adrenérgico ligado à membrana com cavidades expostas à água (azul), não acessível à água (amarelo) e vazios secos (magenta). Crédito:Biozentrum, Universidade de Basel
Quase todas as funções vitais do corpo humano são reguladas pelos chamados receptores acoplados à proteína G na superfície celular. Esses receptores, portanto, servem como alvos de drogas atraentes para tratar várias doenças. Os pesquisadores descobriram agora que os espaços vazios dentro desses receptores são importantes para sua ativação e, portanto, para retransmitir mensagens para a célula interna. Sua abordagem para localizar esses vazios pode ajudar a direcionar a busca por novas drogas.
Os receptores acoplados à proteína G (GPCRs) nos permitem ver, saborear alimentos, sentir frio ou calor ou responder ao estresse, entre outras coisas. Localizados na superfície da célula, os GPCRs detectam uma grande variedade de sinais, como nutrientes, luz, odores ou hormônios. Ao mudar sua conformação, eles transmitem essa informação de fora para dentro da célula. O conhecimento acumulado sobre os GPCRs afetou tremendamente a medicina moderna:cerca de um terço de todos os medicamentos comercializados têm como alvo os GPCRs.
Espaços vazios importantes para a ativação do receptor Usando tecnologia de ponta, a equipe de pesquisa liderada pelo Prof. Stephan Grzesiek, juntamente com colaboradores do Biozentrum da Universidade de Basel e do Instituto Paul Scherrer, descobriu agora que os GPCRs contêm cavidades completamente vazias que são importantes para sua ativação. Sua abordagem experimental recente, publicada em
Nature Chemistry , pode direcionar e acelerar a busca por novos candidatos a medicamentos mais específicos e com menos efeitos colaterais.
Embora os 826 GPCRs dentro do corpo humano respondam a muitos estímulos diferentes, todos compartilham uma arquitetura comum. "Nosso objetivo é entender no nível atômico como os GPCRs transmitem sinais", diz o Dr. Layara Abiko, que co-dirigiu o estudo. "Por muitos anos, estudamos o receptor β1-adrenérgico, um GPCR que prepara o corpo para lutar ou fugir". O hormônio adrenalina se liga e ativa o receptor que desencadeia uma resposta ao estresse, por exemplo, causando um aumento da frequência cardíaca e da pressão arterial." Os betabloqueadores inibem esse receptor e, portanto, são medicamentos eficazes para tratar hipertensão ou doenças cardiovasculares.
Localização exata de vazios secos "Graças à RMN de alta pressão e nossa abordagem experimental usando espalhamento de raios-X em cristais receptores que incorporaram o gás nobre xenônio, pudemos completar ainda mais a imagem desse receptor altamente dinâmico", diz Abiko. "Anteriormente, assumia-se que as cavidades dentro do receptor estavam cheias de água. Agora revelamos que algumas delas estão vazias." Durante a ativação, a conformação do receptor muda de tal forma que esses vazios secos são comprimidos e desaparecem. Consequentemente, o receptor encolhe exatamente como quando você aperta uma esponja. No caso do receptor β1-adrenérgico, essa mudança conformacional é fundamental para iniciar a resposta de luta ou fuga do corpo.
Os pesquisadores agora conseguiram localizar exatamente duas dessas cavidades vazias e revelaram que o colesterol – um importante componente da membrana celular – pode preencher uma delas. Como uma cunha, o colesterol impede o receptor de apertar e mudar para seu estado totalmente ativo. "Bloquear esse vazio obstrui os movimentos sutis, mas essenciais, necessários para ativar o GPCR", explica Abiko. “Achamos que esse efeito de cunha pode ser outra camada de regulação do receptor”.
Novas rotas para o desenvolvimento de medicamentos Mas por que o reconhecimento de vazios secos pode ser importante? Os sítios de ligação de drogas clássicas são frequentemente semelhantes entre as subclasses de GPCR. Um fármaco direcionado a tal local pode se ligar a mais de um receptor e, portanto, causar efeitos colaterais indesejados. Em contraste, as cavidades secas diferem consideravelmente entre os GPCRs, mesmo quando são da mesma subclasse. Isso os torna alvos de drogas altamente seletivos.
"Dessa forma, você pode projetar medicamentos altamente específicos para um receptor", explica Abiko. A nova abordagem desenvolvida pode localizar esses locais de ligação de drogas não convencionais que diferem fortemente entre os receptores. Isso pode ajudar no processo de triagem de novas terapêuticas, economizar tempo e reduzir custos.
+ Explorar mais Explorando os limites dos receptores acoplados à proteína G
