 p Crédito:University of Oregon
p Crédito:University of Oregon
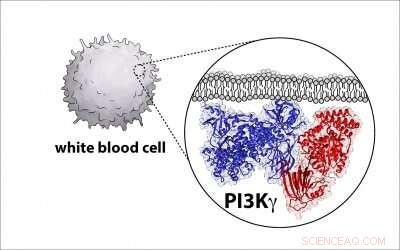
p Os cientistas sabem há décadas que certa classe de enzimas é um jogador importante na biologia celular porque elas freqüentemente sofrem mutações e se tornam as principais responsáveis pelo câncer. p As empresas Biopharma estão tentando desenvolver drogas que visem e inativem essas enzimas, conhecido como fosfoinositídeo 3-quinase, ou PI3K para breve, por causa de seu papel em causar câncer em humanos. Mas para fazer isso, os cientistas precisam de um projeto detalhado da arquitetura da enzima, e o professor de bioquímica da UO, Scott Hansen, faz parte de um grupo que está descobrindo esse diagrama.
p Hansen, um professor assistente no Departamento de Química e Bioquímica da UO, disse que parte do desafio é que as moléculas são complexas, com duas grandes proteínas que se juntam e formam um complexo.
p "Portanto, é um verdadeiro desafio descobrir qual é a estrutura e organização desta proteína, "ele disse." Um pré-requisito para o desenvolvimento de um medicamento é aprender como ele se liga à molécula. Você precisa de um projeto da proteína para encaixar a droga. "
p Agora, Hansen e colegas de várias outras universidades desenvolveram esse modelo para PI3K e identificaram onde uma proteína regulatória crítica se liga à enzima, uma descoberta com potencial para ajudar a impulsionar o esforço para construir drogas contra o câncer mais específicas.
p "Isso definitivamente moldará a forma como as pessoas pensam sobre o desenvolvimento de terapias contra o câncer, " ele disse.
p Hansen é um dos 13 co-autores do artigo publicado na revista
Avanços da Ciência , junto com colegas das universidades de Victoria, Columbia Britânica, Washington e Genebra, e Vrije Universiteit Brussel na Bélgica.
p O que torna o artigo único é "informação estrutural de maior resolução e ser capaz de medir interações biologicamente relevantes com outras moléculas na definição da sequência e prioridade das interações, "Hansen disse.
p Mas ele disse que ainda há muito trabalho a ser feito para entender melhor como outras moléculas se ligam à proteína e modulam sua função.
p Para aprender a estrutura da enzima, os pesquisadores usaram uma técnica chamada microscopia crioeletrônica, que coleta dezenas de milhares de imagens de enzimas P13K únicas em uma camada ultrafina de gelo usando um microscópio eletrônico. As imagens são compiladas e calculadas para criar uma única imagem de alta resolução que revela as características estruturais da enzima.
p Nesse caso, a estrutura da enzima era diferente do que se pensava anteriormente. O novo projeto permitirá aos pesquisadores definir como outras moléculas ativam a proteína.
p "Muitas vezes fazemos pesquisas e obtemos pistas sobre como as proteínas são organizadas ou olhamos para estruturas de moléculas relacionadas e extrapolamos, mas às vezes essas suposições são imprecisas e podem levar um campo para o caminho errado, "Hansen disse." Ter um plano de maior resolução da organização das moléculas permite que as pessoas desenvolvam drogas específicas apenas para aquela molécula. "
p Hansen disse que os pesquisadores envolvidos no artigo passaram 10 anos trabalhando no problema.
p "Isso não é incomum para proteínas realmente complicadas, " ele disse.
p Hansen disse que seu laboratório na UO e o laboratório de John Burke na University of British Columbia conduzem pesquisas complementares. O laboratório de Burke usa microscopia crioeletrônica para obter imagens de moléculas de alta resolução, e o laboratório de Hansen é capaz de "fazer medidas mais dinâmicas que nos permitem medir as interações desta enzima e outros fatores críticos para a ativação."
p Ele disse que é emocionante colaborar com outros cientistas que têm experiência em áreas que ele não possui.
p "Mais e mais, para realizarmos nossas ambições de pesquisa, não podemos apenas contar com as habilidades em nosso próprio laboratório, "ele disse." Os problemas estão ficando muito complicados e você tem que abordá-los de ângulos diferentes e integrar muitos conhecimentos diferentes. "
