Comparar estruturas criogênicas com amostras em temperatura ambiente pode ajudar a identificar erros em modelos computacionais
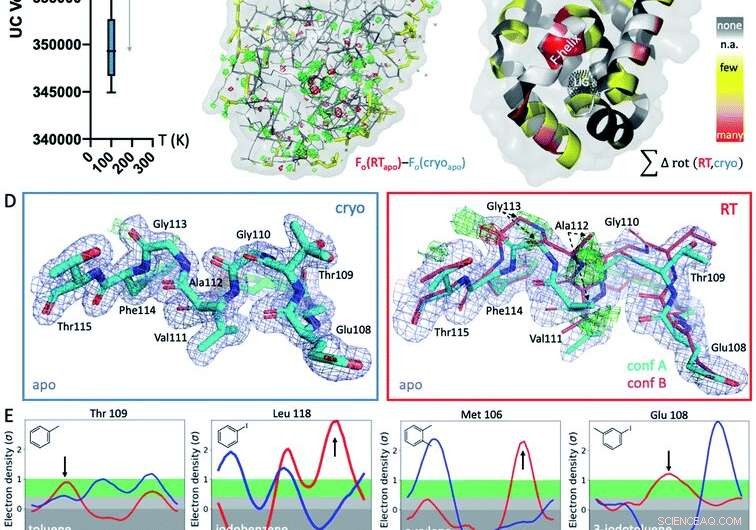 p Fig. 1 Respostas estruturais globais e locais à temperatura. (A) Globalmente, estruturas em temperaturas criogênicas (crio; gráfico azul) são mais variáveis e mais compactas do que seus equivalentes à temperatura ambiente (RT; gráfico vermelho), conforme mostrado pelos volumes de célula unitária média (UC) em 9 estruturas correspondentes coletadas em ambas as temperaturas. (B) O mapa de Fo - Fo isomorfo da estrutura apo coletada em crio versus RT mostra diferenças na densidade de elétrons (malha verde, densidade de elétrons de diferença positiva; malha vermelha, densidade de elétrons de diferença negativa) que indicam efeitos idiossincráticos de temperatura, especialmente em torno do local de ligação do ligante no lobo inferior, indicado pela malha pontilhada preta no painel C (rotulado LIG). (C) A ocorrência de diferenças de rotâmero dependentes da temperatura em todas as 9 estruturas são projetadas nos respectivos resíduos na estrutura apo de T4L; colorido pela sensibilidade à temperatura de cada resíduo em todos os 9 pares de estruturas:amarelo para poucas estruturas, laranja para várias estruturas, e vermelho para a maioria das estruturas apresentando diferenças de temperatura do resíduo; manchas brancas são Gly e Ala que não têm ângulos de Chi; e as manchas cinzas não mostram nenhuma alteração do rotamer com a temperatura. (D) Localmente, Os dados RT da cavidade apo L99A revelam uma conformação F-hélice alternativa (conf. B) nos mapas de diferença de densidade de elétrons Fo - Fc (malha verde e vermelha para densidade positiva e negativa, respectivamente; apenas a conformação ciano A foi incluída no refinamento) que não é visível em crio; 2mFo - mapa DFc mostrado como malha azul; a espessura do bastão representa a ocupação relativa. (E) Todos os 8 complexos de ligando mostram uma mudança na orientação preferida em resposta à temperatura em vez de devido à ligação do ligante para pelo menos 1 resíduo de rotâmero na hélice F perto do local de ligação do ligante. Gráficos de Ringer para resíduos selecionados, com diferenças de rotâmero em RT (vermelho) versus crio (azul) indicado por setas. Crédito:DOI:10.1039 / D1SC02751D
p Fig. 1 Respostas estruturais globais e locais à temperatura. (A) Globalmente, estruturas em temperaturas criogênicas (crio; gráfico azul) são mais variáveis e mais compactas do que seus equivalentes à temperatura ambiente (RT; gráfico vermelho), conforme mostrado pelos volumes de célula unitária média (UC) em 9 estruturas correspondentes coletadas em ambas as temperaturas. (B) O mapa de Fo - Fo isomorfo da estrutura apo coletada em crio versus RT mostra diferenças na densidade de elétrons (malha verde, densidade de elétrons de diferença positiva; malha vermelha, densidade de elétrons de diferença negativa) que indicam efeitos idiossincráticos de temperatura, especialmente em torno do local de ligação do ligante no lobo inferior, indicado pela malha pontilhada preta no painel C (rotulado LIG). (C) A ocorrência de diferenças de rotâmero dependentes da temperatura em todas as 9 estruturas são projetadas nos respectivos resíduos na estrutura apo de T4L; colorido pela sensibilidade à temperatura de cada resíduo em todos os 9 pares de estruturas:amarelo para poucas estruturas, laranja para várias estruturas, e vermelho para a maioria das estruturas apresentando diferenças de temperatura do resíduo; manchas brancas são Gly e Ala que não têm ângulos de Chi; e as manchas cinzas não mostram nenhuma alteração do rotamer com a temperatura. (D) Localmente, Os dados RT da cavidade apo L99A revelam uma conformação F-hélice alternativa (conf. B) nos mapas de diferença de densidade de elétrons Fo - Fc (malha verde e vermelha para densidade positiva e negativa, respectivamente; apenas a conformação ciano A foi incluída no refinamento) que não é visível em crio; 2mFo - mapa DFc mostrado como malha azul; a espessura do bastão representa a ocupação relativa. (E) Todos os 8 complexos de ligando mostram uma mudança na orientação preferida em resposta à temperatura em vez de devido à ligação do ligante para pelo menos 1 resíduo de rotâmero na hélice F perto do local de ligação do ligante. Gráficos de Ringer para resíduos selecionados, com diferenças de rotâmero em RT (vermelho) versus crio (azul) indicado por setas. Crédito:DOI:10.1039 / D1SC02751D
p Cerca de 95% de todas as estruturas cristalinas obtidas para várias proteínas e depositadas em bancos de dados públicos são capturadas por meio de tecnologia criogênica. Esta tecnologia requer condições congeladas. Cientistas do St. Jude Children's Research Hospital compararam as estruturas criogênicas com as observadas à temperatura ambiente. As evidências, publicado hoje em
Ciência Química , indicam que o congelamento pode introduzir erros, fazer com que certas conformações (formas) sejam perdidas e levar a imprecisões em modelos computacionais. p As estruturas das proteínas são essenciais para o processo de desenvolvimento de medicamentos porque fornecem um mapa de como os medicamentos direcionados devem ser projetados.
p "Precisamos repensar como coletamos, analisar e utilizar informações estruturais quando nos propomos a descobrir moléculas bioativas, "disse o autor correspondente, Marcus Fischer, Ph.D., St. Jude Departamento de Biologia Química e Terapêutica. "Você pode ver a temperatura como um botão experimental que podemos girar para explorar conformações de proteínas ocultas."
p
A temperatura faz toda a diferença
p Os pesquisadores mostraram que o congelamento distorce as conformações que as proteínas assumem, frequentemente introduzindo erros nas estruturas. A equipe também descobriu que algumas conformações que ocorrem em condições de temperatura ambiente podem ser perdidas se apenas olharmos para os resultados das técnicas criogênicas.
p Os pesquisadores realizaram uma avaliação sistemática das estruturas criogênicas, começando com a cavidade de lisozima L99A de T4. Esta proteína é considerada um "burro de carga" em biologia estrutural para compreender a estabilidade da proteína, rigidez e termodinâmica de ligação a ligantes. Mudar para a temperatura ambiente revelou novas mudanças estruturais que foram perdidas por décadas.
p A equipe testou quatro classes adicionais de proteínas. Os resultados permaneceram verdadeiros, independentemente do tipo de proteína avaliada.
p "Quando você sai no inverno e está com frio, você se comprime e se encolhe, e ao sol, quando você está quente, você se estica. As proteínas fazem o mesmo, "Fischer disse.
p
Evitando erros
p Métodos computacionais são algoritmos que os pesquisadores usam para fazer previsões ou avaliar os dados obtidos em seus experimentos. Os resultados indicam que quando esses métodos são construídos em dados de estruturas criogênicas, podem ser introduzidos erros que podem prejudicar os resultados futuros.
p As técnicas criogênicas são preferidas há muito tempo porque facilitam a obtenção das estruturas. Colocar as estruturas em temperatura ambiente é mais tedioso. Embora existam maneiras de atenuar esses problemas, Fatores como integridade de dados e danos por radiação são obstáculos adicionais para muitos pesquisadores na obtenção de estruturas em temperatura ambiente.
p Embora a detecção de uma forma de proteína oculta seja informativa, ainda faltava mostrar o impacto da nova forma nos protocolos de descoberta de medicamentos.
p “Vimos que a proteína adotou um estado para interagir com ligantes, e que as informações ausentes podem ajudar a melhorar a precisão da triagem virtual de drogas e simulações de interação proteína-ligante, "disse o co-primeiro autor Shanshan Bradford, Ph.D., St. Jude Departamento de Biologia Química e Terapêutica.
p Os pesquisadores ressaltam que, ao considerar apenas as estruturas criogênicas, não há como saber se há erros, mas essa comparação com as estruturas à temperatura ambiente pode ajudar a esclarecer as informações e, potencialmente, revelar percepções adicionais que, de outra forma, seriam perdidas.
