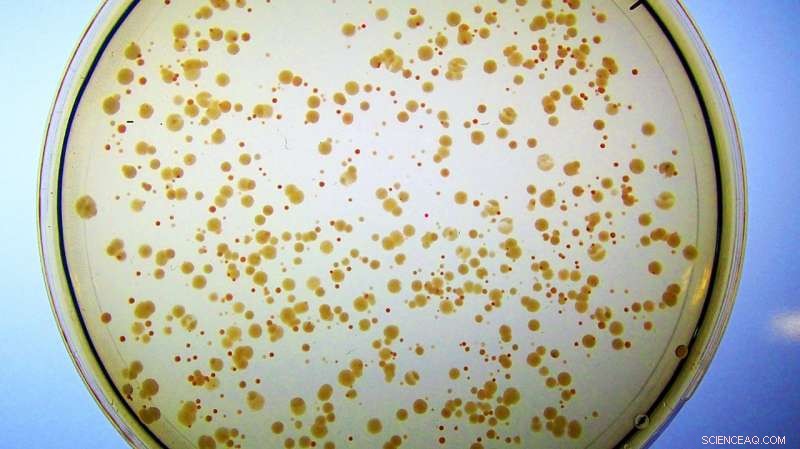
Colônias de E. coli crescem em meio rico em ferro. Todas as células foram projetadas para perder sua enzima Fes natural. Eles formam pequenos, colônias vermelhas prejudiciais à saúde porque acumulam ferro ligado à enterobactina, e mal tem ferro livre suficiente para crescer. Em contraste, células contendo a enzima artificial Syn-F4 formam grandes, colônias brancas saudáveis porque a nova proteína catalisa a clivagem da enterobactina e a liberação subsequente do ferro necessário para o crescimento saudável. (Nota:Se essas células foram colocadas em placas de Petri com o mínimo de ferro, as colônias vermelhas não apareceriam porque não teriam ferro livre suficiente para sustentar o crescimento celular.) Crédito:Ann Donnelly / Hecht Lab / Universidade de Princeton
Um campo de pesquisa nascente, biologia artificial, está trabalhando para criar um organismo genuinamente novo. Em Princeton, o professor de química Michael Hecht e os pesquisadores em seu laboratório estão projetando e construindo proteínas que podem se dobrar e imitar os processos químicos que sustentam a vida. Suas proteínas artificiais, codificado por genes sintéticos, têm aproximadamente 100 aminoácidos de comprimento, usando um arranjo infinitamente variável de 20 aminoácidos.
Agora, Hecht e seus colegas confirmaram que pelo menos uma de suas novas proteínas pode catalisar reações biológicas, o que significa que uma proteína projetada inteiramente do zero funciona nas células como uma enzima genuína.
As enzimas são a chave para toda a biologia, Hecht disse. "Biologia é o sistema de reações bioquímicas e catalisadores. Cada etapa tem uma enzima que a catalisa, porque, de outra forma, essas reações não seriam rápidas o suficiente para a existência de vida. ... Uma enzima é uma proteína que é um catalisador. Eles são os melhores catalisadores do universo porque a evolução gastou bilhões de anos selecionando-os. As enzimas podem aumentar a velocidade de uma reação em muitas ordens de magnitude. "
Uma vez que Hecht e sua equipe de pesquisa criaram com sucesso proteínas artificiais para E. coli, eles começaram a procurar funções críticas que pudessem interromper nessas bactérias simples. Eles encontraram quatro genes que, quando removido, não apenas tornaria a E. coli inerte - efetivamente morta - mas que suas proteínas artificiais poderiam então "resgatar, "ou ressuscitar.
Eles identificaram essas proteínas artificiais pela primeira vez em 2011, e eles passaram os últimos seis anos trabalhando para descobrir os mecanismos precisos pelos quais suas novas proteínas funcionavam, agora detalhado em um artigo de 15 de janeiro em Nature Chemical Biology .
É importante não presumir que uma proteína artificial funcionará da mesma maneira que a natural cuja exclusão ela está resgatando, Hecht advertiu.
A determinação dos mecanismos usados por suas proteínas artificiais exigiu incontáveis experimentos. "Tivemos quatro exclusões de genes diferentes - quatro funções enzimáticas diferentes, "disse Ann Donnelly, autor principal do artigo.
Depois de anos de experimentos, a equipe concluiu que dois desses "resgates" operam substituindo enzimas - proteínas que servem para catalisar outras reações, ajudando-os a operar com rapidez suficiente para sustentar a vida - com proteínas que não eram enzimas, mas que aumentam a produção de outros processos na célula, ela disse. O terceiro estava mostrando progresso, mas o quarto frustrou vários pesquisadores que passaram pelo laboratório de Hecht.
Mas então Donnelly, que era estudante de graduação quando fez a pesquisa e agora é especialista em pesquisa em bioinformática na Universidade de Pittsburgh, quebrou o código.
"Esta proteína artificial, Syn-F4, era na verdade uma enzima, "Donnelly disse." Foi um momento incrível e inacreditável para mim - inacreditável a ponto de eu não querer dizer nada antes de repeti-lo várias vezes.
Ela só disse a Katie Digianantonio, um colega estudante de graduação, e Grant Murphy, um pesquisador de pós-doutorado, que são co-autores do novo artigo. "Eu disse, "Acho que isso é uma enzima." Mostrei a eles os dados iniciais e disse:- Não diga nada a Michael. Deixe-me fazer isso de novo. "Donnelly purificou novamente a proteína, e criou um novo, substrato perfeitamente puro para a E. coli. "Fiz tudo de novo em diferentes preparações - e quando o resultado se manteve, Eu disse a Michael, " ela disse.
Do conjunto original de proteínas que poderiam resgatar exclusões de genes, este é o único que acabou por ser uma enzima - pelo menos até agora, ela disse.
"Temos uma proteína completamente nova que é capaz de sustentar a vida sendo realmente uma enzima - e isso é loucura, "Hecht disse.
Isso tem implicações significativas para a indústria, disse Justin Siegel, diretor docente do Instituto de Inovação para Alimentos e Saúde e professor assistente de química, bioquímica e medicina molecular no UC Davis Genome Center, que não participou da pesquisa.
"A biotecnologia normalmente usa enzimas para realizar processos industriais para a produção de materiais, Comida, combustível e remédios, "Siegel disse." O uso dessas enzimas em um ambiente industrial muitas vezes começa com uma enzima que a natureza desenvolveu por bilhões de anos para um propósito não relacionado, e então a proteína é ajustada para refinar sua função para a aplicação moderna. O relatório aqui demonstra que não estamos mais limitados às proteínas produzidas pela natureza, e que podemos desenvolver proteínas - que normalmente levariam bilhões de anos para evoluir - em questão de meses. "
A equipe de Hecht criou uma cepa de E. coli que não continha a enzima Fes, sem o qual não pode acessar o ferro necessário para sustentar a vida. "Todos nós precisamos de ferro, "Hecht disse." Mesmo que o ferro seja abundante na terra, o ferro biologicamente acessível, não. "As células desenvolveram moléculas como a enterobactina, ele explicou, que pode limpar o ferro de qualquer fonte disponível, mas eles precisam de uma ferramenta - como Fes - para arrancar o ferro das garras da enterobactina.
Esta cepa de E. coli modificada não tinha como extrair, ou hidrolisar, o ferro de sua enterobactina, até que foi "resgatado" por Syn-F4. Os pesquisadores forneceram ferro para a E. coli, mas apenas manchou as células de vermelho, pois embora eles pudessem acumular o metal ligado, eles não podiam liberá-lo da enterobactina ou acessá-lo para uso celular.
"E então Ann percebeu ... eles não são mais vermelhos, eles são brancos, o que sugere que as células podem quebrar isso e obter o ferro, o que sugere que realmente temos uma enzima! ", disse Hecht.
"Milhões de anos de evolução resultaram em Fes, uma enzima perfeitamente boa para hidrolisar enterobactina, "disse Wayne Patrick, um professor sênior de bioquímica na Universidade de Otago, na Nova Zelândia, que não participou da pesquisa. "É fácil estudar a estrutura, função e mecanismo de Fes, e inferir algo sobre sua evolução comparando-o com sequências relacionadas. Mas é muito mais difícil (e mais interessante) perguntar se Fes é a solução para o problema bioquímico da hidrólise da enterobactina - ou se é uma das muitas soluções. Donnelly et al. mostraram que uma enzima que nunca nasceu (exceto artificialmente, em seu laboratório), no entanto, poderia ter sido uma solução igualmente boa (se tivesse tido a oportunidade).
"Essa linha de raciocínio tem várias implicações, "explicou Patrick." Uma é para a vida que resta a ser descoberta na Terra. Talvez um dia, encontraremos uma enzima natural que se parece com Syn-F4, mas toma o lugar de Fes em algum microorganismo ou outro. Pelo menos agora, nós saberemos olhar. Outra implicação é para a astrobiologia. Se houver muitas soluções igualmente prováveis para um problema bioquímico, torna-se mais provável que uma solução tenha sido encontrada em outro lugar do universo. "
Os pesquisadores estão à beira de uma verdadeira biologia sintética, Hecht disse.
"E. coli tem 4, 000 genes diferentes, "ele disse." Nós não testamos todos os 4, 000, porque a única maneira de esse experimento funcionar é se nada crescer no meio mínimo, e dos 4, 000, isso só é verdade para alguns.
"Estamos começando a codificar para um genoma artificial. Resgatamos 0,1 por cento do genoma de E. coli. ... Por enquanto, é uma estranha E. coli com alguns genes artificiais que permitem seu crescimento. Suponha que você substitua 10% ou 20%. Então não é apenas uma E. coli estranha com alguns genes artificiais, então você tem que dizer que é um organismo novo. "