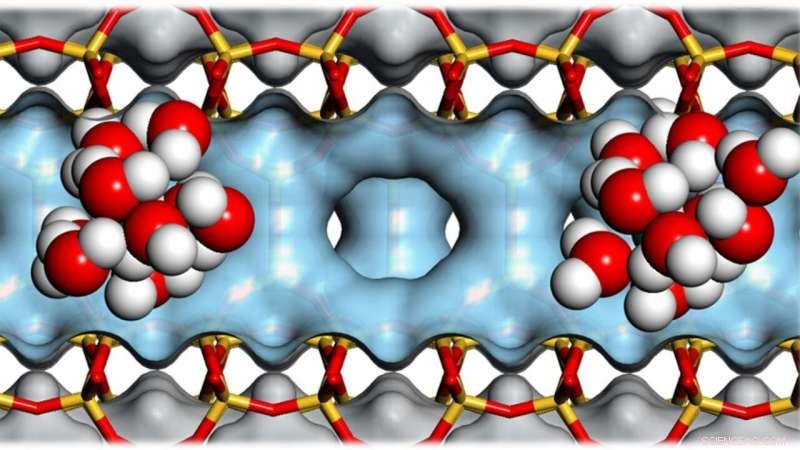
 p Aglomerados de moléculas de água dentro das cavidades dos zeólitos ajudam a catalisar a conversão de biomassa em biocombustível. Crédito:Andreas Jentys / TUM
p Aglomerados de moléculas de água dentro das cavidades dos zeólitos ajudam a catalisar a conversão de biomassa em biocombustível. Crédito:Andreas Jentys / TUM
p Os zeólitos são materiais extremamente porosos:dez gramas podem ter uma superfície interna do tamanho de um campo de futebol. Suas cavidades os tornam úteis para catalisar reações químicas e, assim, economizar energia. Uma equipe de pesquisa internacional fez novas descobertas sobre o papel das moléculas de água nesses processos. Uma aplicação importante é a conversão de biomassa em biocombustível. p Combustível feito de biomassa é considerado neutro para o clima, embora ainda seja necessária energia para produzi-lo:As reações químicas desejadas requerem altos níveis de temperatura e pressão.
p "Se quisermos dispensar as fontes de energia fóssil no futuro e fazer uso eficiente da biomassa em larga escala, também teremos que encontrar maneiras de reduzir a energia necessária para o processamento da biomassa, "diz Johannes Lercher, professor de Tecnologia Química da Universidade Técnica de Munique (TUM) e Diretor do Instituto de Catálise Integrada do Laboratório Nacional do Noroeste do Pacífico em Richland, Washington (EUA).
p Trabalhando junto com uma equipe de pesquisa internacional, Lercher examinou mais de perto o papel das moléculas de água nas reações dentro dos poros do zeólito, que têm menos de um nanômetro de tamanho.
p
Tudo começa com ácidos
p Uma característica de um ácido é que ele doa prótons facilmente. Assim, quando adicionado à água, o ácido clorídrico se divide em ânions de cloreto carregados negativamente, como aqueles encontrados em cristais de sal de cozinha, e prótons carregados positivamente que se ligam às moléculas de água. Isso resulta em um íon hidrônio carregado positivamente, que procura passar adiante este próton, por exemplo, para uma molécula orgânica.
p Quando a molécula orgânica é "forçada" a aceitar um próton, ele tenta se estabilizar. Assim, um álcool pode dar origem a uma molécula com uma ligação dupla - uma etapa de reação típica no caminho da biomassa para o biocombustível. As paredes do zeólito estabilizam os estados de transição que ocorrem durante a conversão e, portanto, ajudam a minimizar a quantidade de energia necessária para que a reação ocorra.
 p O Prof. Lercher em seu laboratório no Departamento de Química da Universidade Técnica de Munique. Crédito:Andreas Heddergott / TUM
p O Prof. Lercher em seu laboratório no Departamento de Química da Universidade Técnica de Munique. Crédito:Andreas Heddergott / TUM
p
Zeólitas agindo como ácidos
p Os zeólitos contêm átomos de oxigênio em sua estrutura cristalina que já carregam um próton. Como os ácidos moleculares, eles formam íons hidrônio por meio das interações com a água.
p Contudo, enquanto os íons de hidrônio se dispersam na água, eles permanecem intimamente associados ao zeólito. O pré-tratamento químico pode variar o número desses centros ativos e, portanto, estabelecer uma certa densidade de íons de hidrônio nos poros da zeólita.
p
O zeólito ideal para cada reação
p Variando sistematicamente o tamanho das cavidades, a densidade dos locais ativos e a quantidade de água, a equipe de pesquisa foi capaz de elucidar os tamanhos de poros e as concentrações de água que melhor catalisaram reações de exemplo selecionadas.
p "Em geral, é possível aumentar a taxa de reação tornando os poros menores e aumentando a densidade de carga, "Johannes Lercher explica." No entanto, esse aumento tem seus limites:quando as coisas ficam muito lotadas e as cargas estão muito próximas uma da outra, a taxa de reação cai novamente. Isso torna possível encontrar as condições ideais para cada reação. "
p "Os zeólitos são geralmente adequados como nanorreatores para todas as reações químicas cujos parceiros de reação se encaixam nos poros e nas quais um ácido é usado como catalisador, "enfatiza Lercher." Estamos no início de um desenvolvimento com potencial para aumentar a reatividade das moléculas mesmo em baixas temperaturas e, portanto, para economizar uma quantidade considerável de energia na produção de combustíveis ou produtos químicos. "

