 p Crédito:Pohang University of Science &Technology (POSTECH)
p Crédito:Pohang University of Science &Technology (POSTECH)
p Os mexilhões sobrevivem colando-se às rochas nas fortes ondas ou marés subaquáticas. Materiais que imitam essa adesão subaquática são amplamente usados para adesão à pele ou osso, para modificar a superfície de um andaime, ou mesmo em sistemas de entrega de drogas ou células. Contudo, esses materiais não imitam inteiramente as capacidades dos mexilhões. p Uma equipe de pesquisa conjunta da POSTECH e da Kangwon National University (KNU) - liderada pelo professor Hyung Joon Cha e Ph.D. o candidato Mincheol Shin do Departamento de Engenharia Química da POSTECH com o Professor Young Mee Jeong e o Dr. Yeonju Park do Departamento de Química da KNU - analisou Dopa e lisina, que são os aminoácidos que constituem as proteínas adesivas superficiais secretadas pelos mexilhões, e verificou se suas funções estão relacionadas à sua localização. A equipe deu um passo mais perto de revelar o segredo da adesão subaquática ao descobrir que esses aminoácidos podem contribuir para a adesão e coesão da superfície de forma diferente, dependendo de sua localização específica.
p A característica das proteínas adesivas do mexilhão que foram imitadas até agora é que elas contêm um grande número de um aminoácido único chamado Dopa. Dopa é um aminoácido modificado com mais um grupo hidroxila ligado à tirosina, e as pesquisas sobre adesão subaquática começaram com o fato de que a Dopa é um grande componente da proteína adesiva.
p Contudo, a equipe de pesquisa questionou o fato de que esta excelente adesão subaquática dos mexilhões é possibilitada por apenas uma molécula e focada na observação do número e localização da lisina, que é um aminoácido tão frequente quanto Dopa.
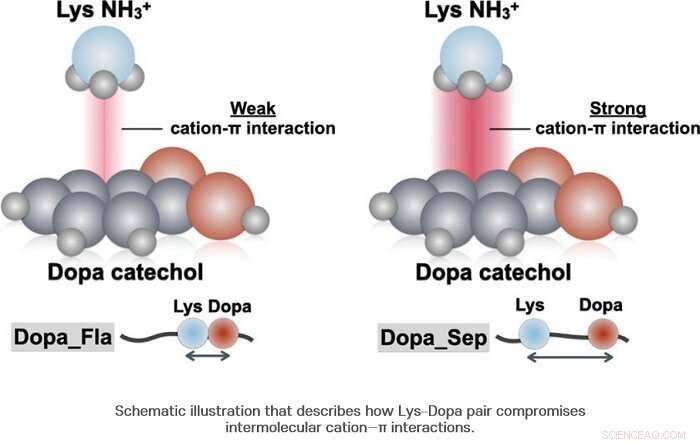
p Como resultado, a equipe de pesquisa descobriu que a dopa e a lisina estão ligadas uma à outra com cerca de metade da probabilidade. Por outro lado, foi revelado que ao contrário do que se sabia até agora, quando a Dopa e a lisina estão ligadas, nem sempre produzem sinergia positiva. Os pesquisadores confirmaram que, no caso da interação cátion-π, a sinergia negativa é produzida.
p Quando Dopa e lisina estão juntas, uma diferença na densidade das moléculas de água ocorre no nível microscópico e a concentração das moléculas de água em torno da Dopa é reduzida. Esta concentração reduzida permite uma diferença na força da ligação de hidrogênio entre o anel de benzeno e o grupo hidroxila de Dopa, diminuindo assim a estabilidade estrutural do complexo cátion-π. Usando espectroscopia Raman, a equipe de pesquisa confirmou que o CH
2 grupo localizado na cadeia de lisina situado perto de Dopa e catecol da Dopa adjacente formam uma interação intramolecular, diminuindo assim sua estabilidade.
p Os resultados deste estudo permitem confirmar como a proteína adesiva do mexilhão foi desenhada, e mostra a promessa de ser aplicável para pesquisas em proteínas adesivas de outros organismos no futuro.
p "Com esta nova descoberta sobre a sinergia entre Dopa e lisina, que são conhecidos por sempre desempenharem um papel positivo na adesão subaquática, vai mudar a estrutura da maneira como os materiais adesivos são projetados, "comentou o professor Hyung Joon Cha, que liderou a pesquisa.
p Essa pesquisa, que foi publicado recentemente em
Química de Materiais , foi conduzido como parte do estudo intitulado "Compreendendo o mecanismo de adesão subaquática de organismos adesivos:controlando o equilíbrio entre a adesão e a coesão da superfície, "que é um Programa de Pesquisador em Meio de Carreira do Ministério da Ciência e TIC e da Fundação Nacional de Pesquisa da Coréia.
