Os cientistas descobrem a estrutura da enzima movida a luz com aplicações potenciais de biocombustíveis
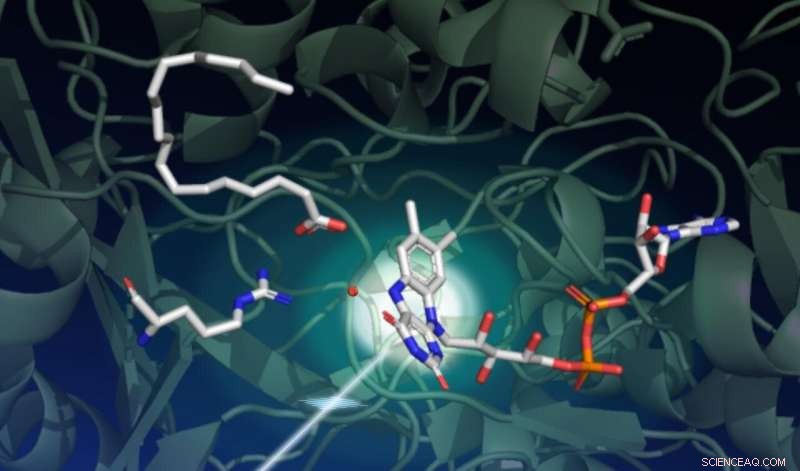 p Um estudo usando o laser de raios-X LCLS do SLAC capturou como a luz impulsiona uma série de mudanças estruturais complexas em uma enzima chamada FAP, que catalisa a transformação de ácidos graxos em ingredientes de partida para solventes e combustíveis. Este desenho captura o estado inicial da reação catalítica. O fundo verde escuro representa o esqueleto da proteína. A parte sensora de luz da enzima, chamado de cofator FAD, é mostrado no centro à direita com seus três anéis absorvendo um fóton vindo do canto inferior esquerdo. Um ácido graxo no canto superior esquerdo aguarda transformação. O aminoácido mostrado no meio à esquerda desempenha um papel importante no ciclo catalítico, e o ponto vermelho próximo ao centro é uma molécula de água. Crédito:Damien Sorigue / Universite Aix-Marseille
p Um estudo usando o laser de raios-X LCLS do SLAC capturou como a luz impulsiona uma série de mudanças estruturais complexas em uma enzima chamada FAP, que catalisa a transformação de ácidos graxos em ingredientes de partida para solventes e combustíveis. Este desenho captura o estado inicial da reação catalítica. O fundo verde escuro representa o esqueleto da proteína. A parte sensora de luz da enzima, chamado de cofator FAD, é mostrado no centro à direita com seus três anéis absorvendo um fóton vindo do canto inferior esquerdo. Um ácido graxo no canto superior esquerdo aguarda transformação. O aminoácido mostrado no meio à esquerda desempenha um papel importante no ciclo catalítico, e o ponto vermelho próximo ao centro é uma molécula de água. Crédito:Damien Sorigue / Universite Aix-Marseille
p Embora muitos organismos capturem e respondam à luz do sol, enzimas - proteínas que catalisam reações bioquímicas - raramente são impulsionadas pela luz. Os cientistas identificaram apenas três tipos de fotoenzimas naturais até agora. O mais novo, descoberto em 2017, é a fotodecarboxilase de ácido graxo (FAP). Derivado de algas microscópicas, ele usa luz azul para catalisar a conversão de ácidos graxos, encontrado em gorduras e óleos, em alcanos e alcenos. p "Um número crescente de laboratórios prevê o uso de FAPs para aplicações de química verde, porque alcanos e alquenos são componentes importantes de solventes e combustíveis, incluindo gasolina e combustíveis para aviões. E a transformação de ácidos graxos em alcanos ou alquenos acontece em uma única etapa dentro da enzima, "diz Martin Weik, líder de um grupo de pesquisa do Institute of Biologie Structurale da Universite Grenoble Alpes.
p Weik é o investigador principal de um novo estudo que capturou a sequência complexa de mudanças estruturais que a FAP sofre em resposta à luz, chamado fotociclo, que impulsiona essa transformação de ácido graxo. Embora os pesquisadores tenham proposto anteriormente um fotociclo FAP, o mecanismo fundamental não foi compreendido. Os cientistas não sabiam quanto tempo leva para um ácido graxo perder seu carboxilato, o grupo químico ligado ao final de sua longa cadeia de hidrocarbonetos, uma etapa crítica na formação de alcenos ou alcanos.
p Em colaboração com cientistas do SLAC, experimentos na Linac Coherent Light Source (LCLS) no Laboratório Nacional do Acelerador SLAC do Departamento de Energia ajudaram a responder a muitas dessas questões pendentes. Os pesquisadores descrevem seus resultados em
Ciência .
p
Todas as ferramentas em uma caixa de ferramentas
p Para entender uma enzima sensível à luz como FAP, os cientistas usam muitas técnicas diferentes para estudar processos que ocorrem em uma ampla gama de escalas de tempo - porque a absorção de fótons acontece em femtossegundos, ou milionésimos de um bilionésimo de segundo, enquanto as respostas biológicas no nível molecular freqüentemente acontecem em milésimos de segundo.
p "Nosso internacional, consórcio interdisciplinar, liderado por Frederic Beisson na Universite Aix-Marseille, usou uma riqueza de técnicas, incluindo espectroscopia, cristalografia e abordagens computacionais, "Weik diz." É a soma desses diferentes resultados que nos permitiu ter um primeiro vislumbre de como essa enzima única funciona em função do tempo e no espaço. "
p O consórcio primeiro estudou as etapas complexas do processo catalítico em seus laboratórios domésticos usando métodos de espectroscopia óptica, que investigam a estrutura eletrônica e geométrica dos átomos nas amostras, incluindo ligação química e carga. Experimentos espectroscópicos identificaram os estados intermediários da enzima que acompanham cada etapa, mediram suas vidas úteis e forneceram informações sobre sua natureza química. Esses resultados motivaram a necessidade de recursos ultrarrápidos do LCLS.
p Próximo, uma visão estrutural do processo catalítico foi fornecida por cristalografia de femtosegundo serial (SFX) com o laser de elétrons livres de raios-X LCLS (XFEL). Durante esses experimentos, um jato de minúsculos microcristais FAP foi atingido com pulsos de laser óptico para iniciar a reação catalítica, seguido por extremamente curto, pulsos ultrabright de raios-X para medir as mudanças resultantes na estrutura da enzima.
p Ao integrar milhares dessas medições - adquiridas usando vários atrasos de tempo entre os pulsos ópticos e de raios-X - os pesquisadores foram capazes de acompanhar as mudanças estruturais na enzima ao longo do tempo. Eles também determinaram a estrutura do estado de repouso da enzima por sondagem sem o laser óptico.
p Surpreendentemente, os pesquisadores descobriram que no estado de repouso, a parte sensora de luz da enzima, chamado de cofator FAD, tem uma forma dobrada. “Este cofator atua como uma antena para capturar fótons. Ele absorve a luz azul e inicia o processo catalítico, "Weik diz." Nós pensamos que o ponto de partida do cofator FAD era plano, então essa configuração dobrada foi inesperada. "
p A forma dobrada do cofator FAD foi realmente descoberta pela primeira vez por cristalografia de raios-X na Instalação Europeia de Radiação Síncrotron, mas os cientistas suspeitaram que esta curva fosse um artefato de dano por radiação, um problema comum para dados cristalográficos coletados em fontes de luz síncrotron. Apenas experimentos SFX podem confirmar esta configuração incomum por causa de sua capacidade única de capturar informações estruturais antes de danificar a amostra, Weik diz.
p "Esses experimentos foram complementados por cálculos, " ele adiciona, "Sem os cálculos quânticos de alto nível realizados por Tatiana Domratcheva da Universidade Estadual de Moscou, não teríamos entendido nossos resultados experimentais. "
p
Próximos passos
p Apesar da melhor compreensão do fotociclo do FAP, perguntas sem resposta permanecem. Por exemplo, os pesquisadores sabem que o dióxido de carbono é formado durante uma determinada etapa do processo catalítico em um momento e local específicos, mas eles não sabem seu estado quando sai da enzima.
p "No futuro trabalho do XFEL, queremos identificar a natureza dos produtos e tirar fotos do processo com um tamanho de etapa muito menor para resolver o processo em detalhes muito mais sutis, "diz Weik." Isso é importante para a pesquisa fundamental, mas também pode ajudar os cientistas a modificar a enzima para fazer uma tarefa para uma aplicação específica. "
