Cobrir as superfícies do catalisador de metal com materiais óxidos bidimensionais finos pode melhorar as reações químicas
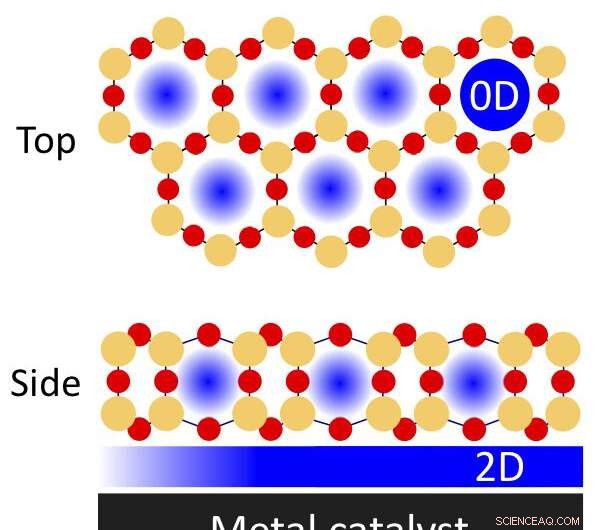 p Uma ilustração de espaços fisicamente confinados em um filme de sílica porosa de camada dupla em um catalisador de metal que pode ser usado para reações químicas. Os átomos de silício são indicados pelos círculos laranja; átomos de oxigênio pelos círculos vermelhos. O nanoconfinamento pode ocorrer nos poros (dimensão zero, ou 0-D) e a região confinada de interface entre o filme e o metal (bidimensional, 2-D). Crédito:Laboratório Nacional de Brookhaven
p Uma ilustração de espaços fisicamente confinados em um filme de sílica porosa de camada dupla em um catalisador de metal que pode ser usado para reações químicas. Os átomos de silício são indicados pelos círculos laranja; átomos de oxigênio pelos círculos vermelhos. O nanoconfinamento pode ocorrer nos poros (dimensão zero, ou 0-D) e a região confinada de interface entre o filme e o metal (bidimensional, 2-D). Crédito:Laboratório Nacional de Brookhaven
p Espaços fisicamente confinados podem tornar as reações químicas mais eficientes, de acordo com estudos recentes conduzidos por cientistas do Laboratório Nacional de Brookhaven do Departamento de Energia dos EUA (DOE). Eles descobriram que a cobertura parcial de superfícies de metal atuando como catalisadores, ou materiais que aceleram as reações, com filmes finos de sílica pode impactar as energias e taxas dessas reações. A sílica fina forma uma matriz bidimensional (2-D) de "gaiolas" em forma de prisma hexagonal contendo átomos de silício e oxigênio. p "Essas estruturas de sílica porosa têm a espessura de apenas três átomos, "explicou Samuel Tenney, um químico no Grupo de Ciência de Interface e Catálise do Brookhaven Lab's Center for Functional Nanomaterials (CFN). "Se os poros fossem muito altos, certos ramos de moléculas não seriam capazes de alcançar a interface. Há uma geometria particular na qual as moléculas podem entrar e se ligar, mais ou menos como a forma como uma enzima e um substrato se unem. Moléculas com o tamanho apropriado podem deslizar através dos poros e interagir com a superfície de metal cataliticamente ativa. "
p "A bicamada de sílica não está realmente ancorada na superfície do metal, "acrescentou Calley Eads, um pesquisador associado do mesmo grupo. "Existem forças fracas entre eles. Essa interação fraca permite que as moléculas não apenas penetrem nos poros, mas também explorem a superfície catalítica e encontrem os locais mais reativos e a geometria de reação otimizada, movendo-se horizontalmente no espaço confinado entre a bicamada e o metal. Se estivesse ancorado, a bicamada teria apenas um local de poro para cada molécula para interagir com o metal. "
p Os cientistas estão descobrindo que os espaços confinados modificam diferentes tipos de reações, e eles estão trabalhando para entender o porquê.
p Tenney e Eads são co-autores correspondentes em pesquisas publicadas recentemente em
Angewandte Chemie , demonstrando este efeito de confinamento para uma reação industrialmente importante:a oxidação do monóxido de carbono. O monóxido de carbono é um componente tóxico do escapamento do motor de veículos e, portanto, deve ser removido. Com a ajuda de um catalisador de metal precioso adequado, como paládio, platina, ou ródio, conversores catalíticos em veículos combinam monóxido de carbono com oxigênio para formar dióxido de carbono.
p Tenney, Eads, e colegas do CFN e da Fonte de Luz Síncrotron Nacional II de Brookhaven (NSLS-II) mostraram que cobrir o paládio com sílica aumenta a quantidade de dióxido de carbono produzida em 20 por cento, em comparação com a reação em paládio puro.
p Para alcançar esse aprimoramento de desempenho, os cientistas primeiro tiveram que obter uma estrutura de bicamada completa na superfície do paládio. Para fazer isso, eles aqueciam uma quantidade calibrada de silício a temperaturas de sublimação em um ambiente de oxigênio de alta pressão. Na sublimação, um sólido se transforma diretamente em um gás. À medida que a fina película de sílica estava sendo criada, eles sondaram sua estrutura com difração de elétrons de baixa energia. Nesta técnica, elétrons que atingem um material difratam em um padrão característico da estrutura cristalina do material.
p "Continuamos aquecendo até obtermos estruturas altamente cristalinas com tamanhos de poros bem definidos que podemos usar para explorar a química na qual estamos interessados, "disse Eads.
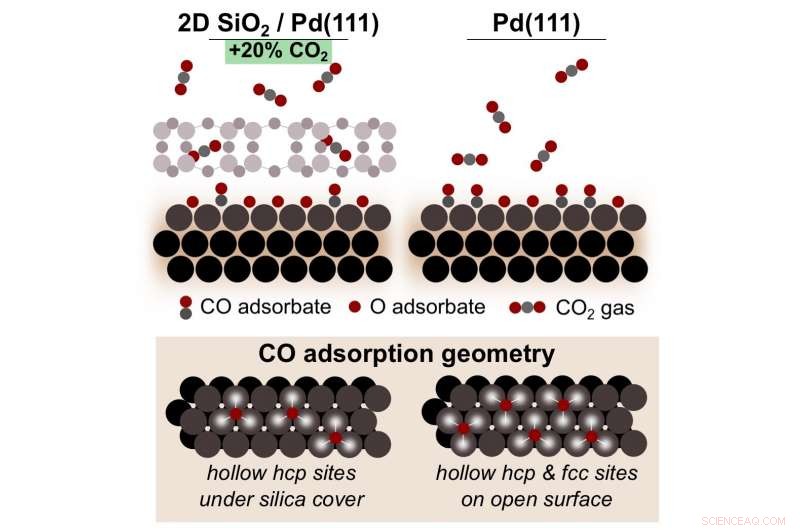 p Um esquema que mostra como a oxidação de monóxido de carbono (CO) em paládio (Pd) sob uma sílica microporosa 2-D (SiO, 2) a cobertura produz 20 por cento mais dióxido de carbono (CO 2 ), em comparação com a reação em Pd puro. Este microambiente interfacial promove uma maior cobertura de óxidos de superfície Pd reativos que são essenciais para a conversão de CO em CO 2 . Crédito:Laboratório Nacional de Brookhaven
p Um esquema que mostra como a oxidação de monóxido de carbono (CO) em paládio (Pd) sob uma sílica microporosa 2-D (SiO, 2) a cobertura produz 20 por cento mais dióxido de carbono (CO 2 ), em comparação com a reação em Pd puro. Este microambiente interfacial promove uma maior cobertura de óxidos de superfície Pd reativos que são essenciais para a conversão de CO em CO 2 . Crédito:Laboratório Nacional de Brookhaven
p Aqui, a equipe rastreou reagentes e produtos e o ambiente de ligação química no espaço confinado 2-D durante a oxidação do monóxido de carbono, aumentando incrementalmente a temperatura. Para rastrear essas informações, eles conduziram simultaneamente espectroscopia de fotoelétrons de raios-X de pressão ambiente (AP-XPS) e espectrometria de massa (MS) no NSLS-II e espectroscopia de absorção de reflexão de infravermelho (IRAAS) no CFN.
p "AP-XPS nos diz quais elementos estão presentes, estejam na superfície ou na fase gasosa, "disse Tenney." Também pode nos dar informações sobre o estado de oxidação química ou geometria de ligação dos átomos - se um carbono está ligado a um ou dois átomos de oxigênio, por exemplo. MS nos ajuda a identificar as moléculas da fase gasosa que vemos evoluir em nosso sistema com base em seu peso e carga. IRRAS é uma impressão digital do tipo de ligações químicas presentes entre os átomos e mostra a conformação e orientação das moléculas de monóxido de carbono adsorvidas na superfície. "
p De acordo com o co-autor Dario Stacchiola, líder do CFN Interface Science and Catalysis Group, uma das capacidades únicas da equipe é a capacidade de usar ferramentas complementares de caracterização de superfície para analisar a mesma amostra sem expô-la ao ar, o que pode causar contaminação.
p "A reprodutibilidade é frequentemente um problema na catálise, "disse Stacchiola." Mas temos uma configuração que nos permite preparar uma amostra em condições de ultra-alto vácuo muito puras e expor a mesma amostra a pressões de gases industrialmente relevantes. "
p Os resultados experimentais mostraram um aumento acentuado na quantidade de dióxido de carbono acima de uma temperatura crítica. Abaixo desta temperatura, monóxido de carbono "envenena" a superfície, impedindo que a reação prossiga. Contudo, uma vez que o limite de temperatura é atingido, o oxigênio molecular começa a se dividir em dois átomos de oxigênio individuais na superfície do paládio e formar um óxido de superfície. Esses átomos de oxigênio se combinam com o monóxido de carbono para formar dióxido de carbono, evitando assim o envenenamento.
p "O espaço confinado está mudando a energética e a cinética da reação para produzir mais dióxido de carbono, "disse Eads, que liderou a implementação recente desta nova abordagem de análise de superfície multimodal para estudar filmes nanoporosos em condições operacionais.
p "Ao aplicar filmes finos sobre um catalisador tradicional que tem sido estudado há décadas, introduzimos um "botão" para ajustar a química para certas reações, "disse Tenney." Mesmo uma melhoria de um por cento na eficiência do catalisador pode se traduzir em economia na produção em grande escala. "
p "Descobrimos que uma camada muito fina de um óxido barato pode aumentar significativamente a atividade catalítica sem aumentar a quantidade do caro metal precioso usado como catalisador, "adicionou Stacchiola.
 p Crescimento e caracterização de um filme de sílica de duas camadas usando um microscópio eletrônico de baixa energia (LEEM) com imagem de campo total. Esse tipo de microscopia permite que os cientistas acompanhem as mudanças na estrutura do filme à medida que ele cresce em tempo real. A Figura (a) mostra uma superfície de paládio limpa fotografada com LEEM (esfera grande) e seu padrão de difração de elétrons (esfera pequena). A Figura (b) mostra os padrões de imagem e difração para sílica de bicamada (SiO2) cultivada em paládio. Crédito:Laboratório Nacional de Brookhaven
p Crescimento e caracterização de um filme de sílica de duas camadas usando um microscópio eletrônico de baixa energia (LEEM) com imagem de campo total. Esse tipo de microscopia permite que os cientistas acompanhem as mudanças na estrutura do filme à medida que ele cresce em tempo real. A Figura (a) mostra uma superfície de paládio limpa fotografada com LEEM (esfera grande) e seu padrão de difração de elétrons (esfera pequena). A Figura (b) mostra os padrões de imagem e difração para sílica de bicamada (SiO2) cultivada em paládio. Crédito:Laboratório Nacional de Brookhaven
p Anteriormente, a equipe estudou a dinâmica da reação do álcool furfurílico em uma superfície de paládio coberta por sílica de duas camadas. O álcool furfurílico é uma molécula derivada da biomassa que pode ser convertida em biocombustível. Em comparação com a oxidação de monóxido de carbono, que faz apenas um único produto, reações com biomoléculas maiores e mais complexas, como o álcool furfurílico, podem gerar muitos subprodutos indesejáveis. Seus dados preliminares mostraram o potencial para ajustar a seletividade da reação do álcool furfurílico com a cobertura de sílica de bicamada.
p "Alterar a atividade catalítica é ótimo - isso é o que vemos no estudo de oxidação de monóxido de carbono, "disse Stacchiola." O próximo passo é provar que podemos usar as tampas de óxido para ajustar a seletividade para reações específicas. Achamos que nossa abordagem pode ser amplamente aplicada em catálise. "
p Ano passado, outros membros do grupo de Stacchiola - junto com colegas do CFN Theory and Computation Group, Stony Brook University (SBU), e a University of Wisconsin – Milwaukee - publicou um estudo relacionado em
Catálise ACS , um jornal da American Chemical Society (ACS). Combinando experimento e teoria, eles descobriram por que a reação de formação de água catalisada pelo metal rutênio é acelerada sob confinamento com sílica de bicamada.
p “Química em espaços confinados é uma área de pesquisa bastante nova, "disse o co-autor correspondente Deyu Lu, um físico do CFN Theory and Computation Group. "Na última década, tem havido muitos relatos de que o confinamento afeta a química, mas uma compreensão mecanicista na escala atômica tem faltado em grande parte. "
p No
Catálise ACS estude, a equipe do CFN demonstrou que o confinamento pode mudar a via pela qual a reação ocorre. A formação de água pode ocorrer por duas vias de reação possíveis:hidrogenação direta e desproporcionamento. A principal diferença é como o primeiro grupo hidroxila - oxigênio ligado ao hidrogênio - é feito. De acordo com cálculos de Lu e primeiro autor e estudante da SBU, Mengen Wang - esta etapa de reação é a que mais custa energia.
p No caminho direto, moléculas de hidrogênio se dissociam na superfície em dois átomos de hidrogênio, que se combinam com um oxigênio quimicamente absorvido na superfície. Esses grupos hidroxila combinam-se com outro átomo de hidrogênio para formar água. Para o caminho de desproporção, a água - que ainda pode inicialmente vir do caminho direto - primeiro precisa ser estabilizada na superfície. Então, a água pode se combinar com o oxigênio da superfície para formar dois grupos hidroxila na superfície. Esses grupos hidroxila podem se juntar a dois átomos de hidrogênio para formar duas moléculas de água. Essas moléculas de água podem então formar mais grupos hidroxila, formando um laço na via de desproporção.
p Em experimentos AP-XPS baseados em laboratório no CFN, a equipe descobriu que a temperatura necessária para ativar a reação de formação de água era muito mais baixa quando a sílica estava cobrindo o rutênio, em comparação com o metal por si só.
p "O fato de a reação ocorrer em temperaturas mais baixas em confinamento está parcialmente relacionado à sua energia de ativação mais baixa, "explicou o co-autor correspondente Anibal Boscoboinik, um químico no CFN Interface Science and Catalysis Group. "A partir dos dados AP-XPS sobre oxigênio de superfície, podemos derivar indiretamente a energia necessária para ativar a reação. Vemos que essa energia de ativação é muito mais baixa quando a sílica está sobre o rutênio. "
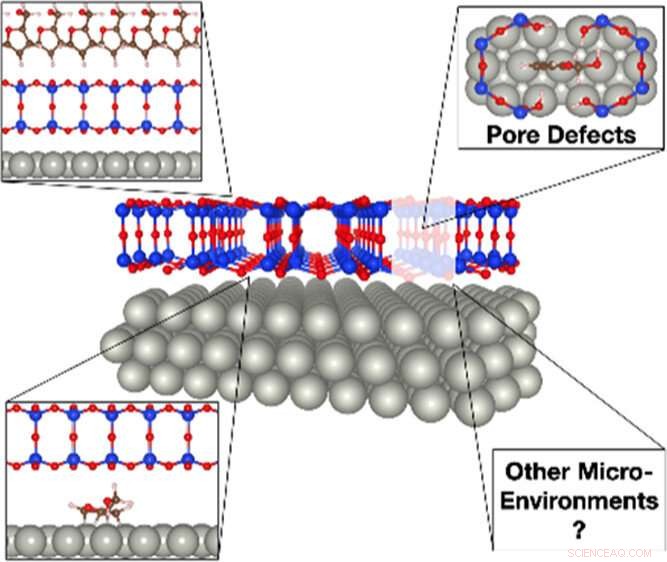 p Uma ilustração do impacto da sílica de duas camadas na conversão de biomassa. Moléculas de biomassa volumosas, como o álcool furfurílico, só podem se infiltrar no filme de sílica em locais com defeitos de poro para interagir com o paládio cataliticamente ativo. Uma vez preso abaixo da cobertura de sílica, o álcool furfurílico pode se decompor em vários derivados, notavelmente propano, que é difícil de produzir na superfície aberta. Crédito:Laboratório Nacional de Brookhaven
p Uma ilustração do impacto da sílica de duas camadas na conversão de biomassa. Moléculas de biomassa volumosas, como o álcool furfurílico, só podem se infiltrar no filme de sílica em locais com defeitos de poro para interagir com o paládio cataliticamente ativo. Uma vez preso abaixo da cobertura de sílica, o álcool furfurílico pode se decompor em vários derivados, notavelmente propano, que é difícil de produzir na superfície aberta. Crédito:Laboratório Nacional de Brookhaven
p Aplicando um método computacional popular chamado teoria do funcional da densidade, a equipe usou supercomputadores para estudar a energética da reação. Inicialmente, os experimentalistas levantaram a hipótese de que a energia de ativação reduzida para a etapa de limitação de velocidade da reação (formando o primeiro grupo hidroxila) era devido à pressão da sílica no complexo de reação. Contudo, os cálculos mostraram que a presença de sílica não alterou significativamente essa energia. Em vez, mudou o caminho da reação. Na superfície de rutênio nua, o caminho direto foi favorecido; na presença de sílica, moléculas de água estabilizadas na superfície, ativando a via de desproporção.
p "Sem a cobertura de sílica, as moléculas de água são dessorvidas, e a reação segue o caminho direto, "disse Lu." Sob a tampa de sílica, a água precisa cruzar várias barreiras de energia cinética para sair da superfície. Essas barreiras cinéticas prendem as moléculas de água na superfície do metal e ativam a via de desproporção, permitindo que os grupos hidroxila sejam feitos em uma barreira de energia muito mais baixa, em comparação com o caso sem os efeitos do confinamento. "
p Embora a formação de água não seja industrialmente relevante, os cientistas dizem que estudar este modelo de reação pode ajudá-los a entender como potencializar os efeitos do confinamento para favorecer certas vias de reação para reações mais relevantes. Em outras palavras, o mesmo princípio fundamental pode ser aplicado a outros sistemas. Por exemplo, a sílica pode ser revestida em eletrodos para evocar caminhos particulares em interfaces líquido-sólido em células eletroquímicas. Nesse caso, a reação seria o oposto - a água seria dissociada em oxigênio e hidrogênio, um combustível limpo.
p "Entender essa reação nos ajuda a entender a reação reversa, "disse Boscoboinik, que publicou recentemente um resumo dos estudos iniciais sobre os efeitos do confinamento com filmes finos porosos 2-D. "Se fôssemos guiados apenas por experimentos, teríamos atribuído a explicação errada. A teoria provou que nossa hipótese inicial estava incorreta e desempenhou um papel fundamental em revelar o mecanismo de reação correto no nível microscópico. "
p Ainda, os cientistas viram outros exemplos em que a sílica tem um efeito relacionado à pressão. Em 2019, eles descobriram que a sílica de bicamada pressiona o gás nobre xenônio na interface entre a sílica de bicamada e o rutênio, induzindo uma ligação mais forte entre o xenônio e o rutênio.
p "Diferentes efeitos surgem do confinamento, "disse Stacchiola." É muito interessante, rico, e área em sua maioria inexplorada. Estamos entusiasmados em continuar investigando a química em espaços confinados nos próximos anos. "



