Biofilmes funcionais de E. coli responsivos à luz como andaimes para mineralização de hidroxiapatita
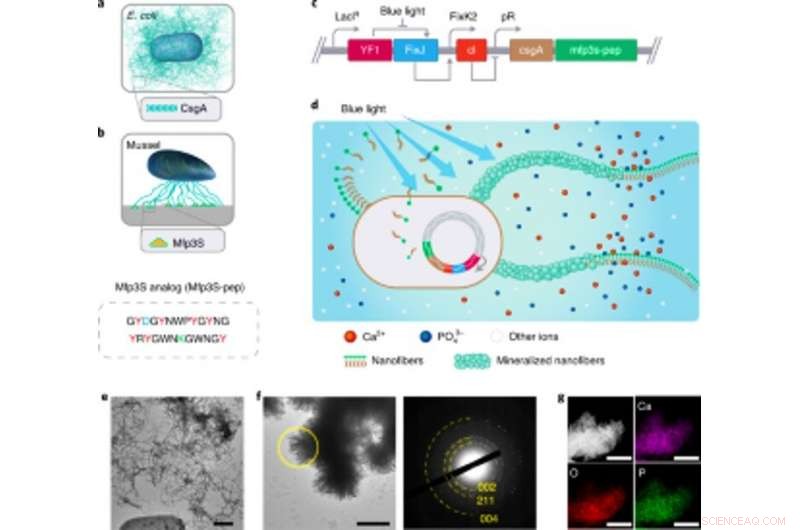 p Engenharia de biofilmes funcionais de E. coli responsivos à luz como andaimes para mineralização de HA. Engenharia de biofilmes funcionais de E. coli responsivos à luz como andaimes para mineralização de HA. (a) Ilustração esquemática de biofilmes de E. coli de tipo selvagem compreendendo nanofibras amiloides CsgA extracelulares, que são os principais componentes da proteína do biofilme que contribuem para a aderência robusta dos biofilmes às superfícies sólidas. (b) Ilustração esquemática de Mfps das placas adesivas do mexilhão da Califórnia M. californianus. Mfp3S-pep (abaixo) é um peptídeo adesivo bioinspirado que imita a proteína Mfp3S original encontrada nas placas adesivas de M. californianus. Mfp3S-pep é enriquecido com ácido aspártico (azul), resíduos de lisina (verde) e tirosina (vermelho), conhecido por seus papéis funcionais na promoção da nucleação, crescimento e adesão de HA. (c) Esquema mostrando os componentes genéticos do biofilme de E. coli responsivo à luz. O projeto de biofilmes funcionais foi possibilitado pela fusão de sequências que codificam a proteína CsgA e Mfp3S-pep, ambos posicionados a jusante do elemento de controle transcricional pDawn sensível à luz. No circuito pDawn, a expressão constitutiva da histidina quinase YF1 e seu regulador de resposta cognata FixJ é rigidamente regulada pelo promotor LacIq, enquanto a expressão do repressor de fago λ cl é controlada pelo promotor FixK2. Após a iluminação de luz azul, a atividade da quinase de YF1 e a expressão consequente de cI são ambas inibidas, que por sua vez ativa o promotor λ pR para promover a expressão de CsgA-Mfp3S-pep. (d) Esquema mostrando a deposição local de minerais HA nas nanofibras extracelulares funcionais compostas por proteínas de fusão CsgA-Mfp3S-pep, secretado por E. coli responsiva à luz projetada, a cepa lightreceiver-CsgA– Mfp3S-pep. (e) Imagem TEM mostrando células e matriz extracelular com fibras amilóides abundantes nos biofilmes. Barra de escala, 500 nm. f, Imagem TEM mostrando o compósito formado e os cristais semelhantes a ripas precipitados nas superfícies de nanofibras extracelulares após 7 d de mineralização em 1,5 × SBF. O padrão SAED correspondente apresenta arcos de difração atribuídos ao (002), (211) e (004) planos. Barra de escala, 500 nm. g, Mapeamento EDS ilustrando o Ca, Elementos O e P intrinsecamente atribuídos à fase HA. Barras de escala, 500 nm. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
p Engenharia de biofilmes funcionais de E. coli responsivos à luz como andaimes para mineralização de HA. Engenharia de biofilmes funcionais de E. coli responsivos à luz como andaimes para mineralização de HA. (a) Ilustração esquemática de biofilmes de E. coli de tipo selvagem compreendendo nanofibras amiloides CsgA extracelulares, que são os principais componentes da proteína do biofilme que contribuem para a aderência robusta dos biofilmes às superfícies sólidas. (b) Ilustração esquemática de Mfps das placas adesivas do mexilhão da Califórnia M. californianus. Mfp3S-pep (abaixo) é um peptídeo adesivo bioinspirado que imita a proteína Mfp3S original encontrada nas placas adesivas de M. californianus. Mfp3S-pep é enriquecido com ácido aspártico (azul), resíduos de lisina (verde) e tirosina (vermelho), conhecido por seus papéis funcionais na promoção da nucleação, crescimento e adesão de HA. (c) Esquema mostrando os componentes genéticos do biofilme de E. coli responsivo à luz. O projeto de biofilmes funcionais foi possibilitado pela fusão de sequências que codificam a proteína CsgA e Mfp3S-pep, ambos posicionados a jusante do elemento de controle transcricional pDawn sensível à luz. No circuito pDawn, a expressão constitutiva da histidina quinase YF1 e seu regulador de resposta cognata FixJ é rigidamente regulada pelo promotor LacIq, enquanto a expressão do repressor de fago λ cl é controlada pelo promotor FixK2. Após a iluminação de luz azul, a atividade da quinase de YF1 e a expressão consequente de cI são ambas inibidas, que por sua vez ativa o promotor λ pR para promover a expressão de CsgA-Mfp3S-pep. (d) Esquema mostrando a deposição local de minerais HA nas nanofibras extracelulares funcionais compostas por proteínas de fusão CsgA-Mfp3S-pep, secretado por E. coli responsiva à luz projetada, a cepa lightreceiver-CsgA– Mfp3S-pep. (e) Imagem TEM mostrando células e matriz extracelular com fibras amilóides abundantes nos biofilmes. Barra de escala, 500 nm. f, Imagem TEM mostrando o compósito formado e os cristais semelhantes a ripas precipitados nas superfícies de nanofibras extracelulares após 7 d de mineralização em 1,5 × SBF. O padrão SAED correspondente apresenta arcos de difração atribuídos ao (002), (211) e (004) planos. Barra de escala, 500 nm. g, Mapeamento EDS ilustrando o Ca, Elementos O e P intrinsecamente atribuídos à fase HA. Barras de escala, 500 nm. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
p Os organismos vivos desenvolveram mecanismos de biomineralização para construir materiais compostos estruturalmente ordenados e ambientalmente adaptáveis. Embora as equipes de pesquisa tenham melhorado significativamente a pesquisa de mineralização biomimética no laboratório, ainda é difícil projetar compósitos mineralizados com características estruturais e componentes vivos muito parecidos com seus equivalentes nativos. Em um novo relatório agora publicado em
Nature Chemical Biology , Yanyi Wang e uma equipe de pesquisa em física, materiais avançados, biologia sintética, e engenharia na China, desenvolveu compostos vivos padronizados e gradientes inspirados em materiais naturais graduados. Eles acoplaram a formação de biofilme bacteriano induzível por luz com a mineralização de hidroxiapatita biomimética (HA) neste trabalho, para mostrar como a localização e o grau de mineralização podem ser controlados. As células nos compostos permaneceram viáveis enquanto detectavam e respondiam aos sinais ambientais. Os compósitos mostraram um aumento de 15 vezes no módulo de Young (ou seja, rigidez, a razão entre o estresse e a deformação) após a mineralização. O trabalho lança luz para desenvolver compósitos vivos com capacidade de resposta dinâmica e adaptabilidade ambiental. p
Biomineralização em laboratório
p O organismo vivo pode produzir uma variedade de estruturas compostas orgânico-inorgânicas hierárquicas com base na biomineralização, onde exemplos notáveis incluem os dentes radulares de quitons, escamas de peixes e mandíbulas de lagostim que cumprem diversas funções biológicas. O tempo e o grau de biomineralização devem ser controlados com precisão pelas células para formar estruturas e funções precisas nos organismos vivos. Pesquisas recentes em mineralização biomimética destacaram a importância de explorar abordagens controladas por células para produzir padrões de vida e compostos graduados como uma área promissora, mas amplamente inexplorada. As disciplinas de biologia sintética e ciência dos materiais desencadearam uma série de circuitos genéticos sofisticados e ecológicos para a bioengenharia de uma série de novas funções celulares. Nesse trabalho, Wang et al. desenvolvido bioinspirado, materiais compostos vivos pelo aproveitamento de biofilmes de Escherichia coli indutíveis por luz juntamente com mineralização biomimética. O trabalho abrirá portas para integrar células projetadas para produzir materiais mineralizados com características estruturais e vivas.
p
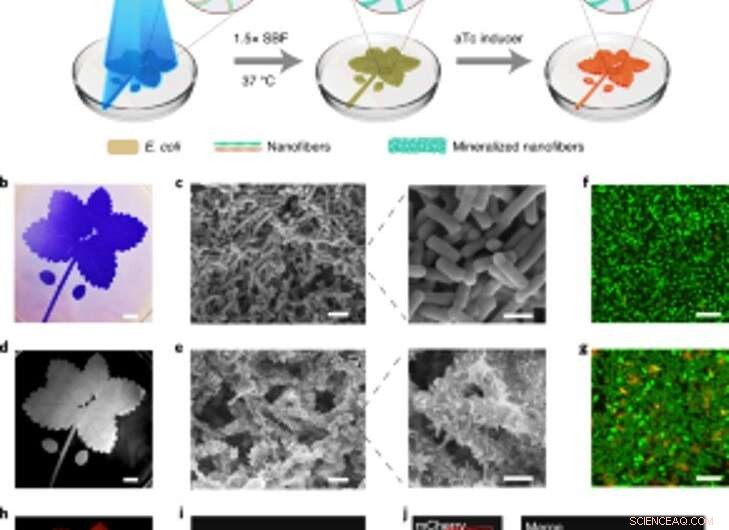 p Mineralização espacialmente controlável de biofilmes indutíveis por luz para compósitos vivos padronizados. (a) Esquema da configuração experimental e etapas sequenciais para a produção de compósitos padronizados vivos. O padrão de folha azul representado na ilustração foi projetado em uma placa de Petri contendo a cepa lightreceiver-CsgA-Mfp3S-pep suspensa no meio. A luz azul desencadeia a formação de biofilme funcional por meio da expressão regulada por luz das proteínas CsgA-Mfp3S-pep da cepa lightreceiver-CsgA-Mfp3S-pep. O meio de cultura na placa de Petri foi então substituído por 1,5 × SBF, seguido de incubação a 37 ° C para formar os compósitos. Após o processo de mineralização, aTc foi adicionado para induzir a expressão de uma proteína fluorescente vermelha (mCherry). (b) Imagem de câmera digital dos biofilmes padronizados corados com CV. Barra de escala, 1 cm. (c) Imagens SEM mostrando a morfologia da superfície dos biofilmes padronizados. Barras de escala:2 µm (esquerda), 1 µm (direita). (d) Imagem da câmera digital do composto mineralizado subsequente que manteve o padrão original. Barra de escala, 1 cm. (e) Imagens SEM mostrando as microestruturas de superfície do compósito mineralizado. Barras de escala:2 µm (esquerda), 1 µm (direita). (f, g) Análise de microscopia confocal de varredura a laser da viabilidade bacteriana em biofilmes (f) e compósitos (g). Barras de escala, 5 µm. Observe que o corante SYTO 9 e o PI foram aplicados como agentes de marcação para corar células vivas (verdes) e mortas (vermelhas), respectivamente. (h) Fluorescência induzida do composto vivo registrada com um sistema ChemiDoc XRS. Barra de escala, 1 cm. eu, A microscopia confocal demonstrou a expressão de mCherry das bactérias no composto. Barra de escala, 20 µm. j, Imagens confocais de uma composição viva após induzir a expressão de mCherry e rotular com calceína, que indicou uma distribuição homogênea de componentes orgânicos e minerais inorgânicos dentro dos compostos vivos padronizados. Barras de escala, 20 µm. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
Seleção de módulos de proteína para mineralização de hidroxiapatita (HA) e desenvolvimento de um biofilme sensível à luz
p Mineralização espacialmente controlável de biofilmes indutíveis por luz para compósitos vivos padronizados. (a) Esquema da configuração experimental e etapas sequenciais para a produção de compósitos padronizados vivos. O padrão de folha azul representado na ilustração foi projetado em uma placa de Petri contendo a cepa lightreceiver-CsgA-Mfp3S-pep suspensa no meio. A luz azul desencadeia a formação de biofilme funcional por meio da expressão regulada por luz das proteínas CsgA-Mfp3S-pep da cepa lightreceiver-CsgA-Mfp3S-pep. O meio de cultura na placa de Petri foi então substituído por 1,5 × SBF, seguido de incubação a 37 ° C para formar os compósitos. Após o processo de mineralização, aTc foi adicionado para induzir a expressão de uma proteína fluorescente vermelha (mCherry). (b) Imagem de câmera digital dos biofilmes padronizados corados com CV. Barra de escala, 1 cm. (c) Imagens SEM mostrando a morfologia da superfície dos biofilmes padronizados. Barras de escala:2 µm (esquerda), 1 µm (direita). (d) Imagem da câmera digital do composto mineralizado subsequente que manteve o padrão original. Barra de escala, 1 cm. (e) Imagens SEM mostrando as microestruturas de superfície do compósito mineralizado. Barras de escala:2 µm (esquerda), 1 µm (direita). (f, g) Análise de microscopia confocal de varredura a laser da viabilidade bacteriana em biofilmes (f) e compósitos (g). Barras de escala, 5 µm. Observe que o corante SYTO 9 e o PI foram aplicados como agentes de marcação para corar células vivas (verdes) e mortas (vermelhas), respectivamente. (h) Fluorescência induzida do composto vivo registrada com um sistema ChemiDoc XRS. Barra de escala, 1 cm. eu, A microscopia confocal demonstrou a expressão de mCherry das bactérias no composto. Barra de escala, 20 µm. j, Imagens confocais de uma composição viva após induzir a expressão de mCherry e rotular com calceína, que indicou uma distribuição homogênea de componentes orgânicos e minerais inorgânicos dentro dos compostos vivos padronizados. Barras de escala, 20 µm. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
Seleção de módulos de proteína para mineralização de hidroxiapatita (HA) e desenvolvimento de um biofilme sensível à luz
p A equipe selecionou proteínas de fusão para projetar a mineralização, promovendo biofilmes de E. coli. Com base em experiências anteriores, eles selecionaram a proteína Mefp5 - originária de Mytilus edulis, seguido por Mfp3S - originário de Mytilus californianus e outra variante do peptídeo Mfp3S (Mfsp3S-pep) para iniciar a mineralização e promover a adesão. A equipe construiu proteínas de fusão contendo um domínio de proteína principal do biofilme de E. coli para formar proteínas de fusão CsgA-Mfp e confirmou sua secreção potencial de células modificadas. Eles então selecionaram a proteína de fusão CsgA-Mfp3S-pep como representante para a mineralização da hidroxiapatita e conduziram experimentos para verificar a função da proteína para destacar seu papel durante a mineralização e formação de cristais. Depois disso, Wang et al. construiu uma cepa formadora de biofilme induzível por luz chamada luz
receptor -CsgA-Mfp3S-pep que pode ser rigidamente regulado por meio de iluminação de luz azul.
p A cepa sensível à luz pode gerar materiais de biofilme funcional após iluminação com luz para promover a mineralização de hidroxiapatita (HA). Para validar isso, os cientistas expuseram a cepa sensível à luz à luz azul em uma placa de Petri e usaram coloração histológica e imagens de microscopia eletrônica de transmissão (TEM) para mostrar a produção de fibras amilóides nos biofilmes. Comparativamente, eles não observaram fibras amilóides em amostras crescidas no escuro. A matriz extracelular projetada também atuou como um modelo para a mineralização de HA no tempo, que eles confirmaram após 7 dias de incubação com base em técnicas de difração de raios-X (XRD) e espectroscopia de energia dispersiva de raios-X (EDS).
p
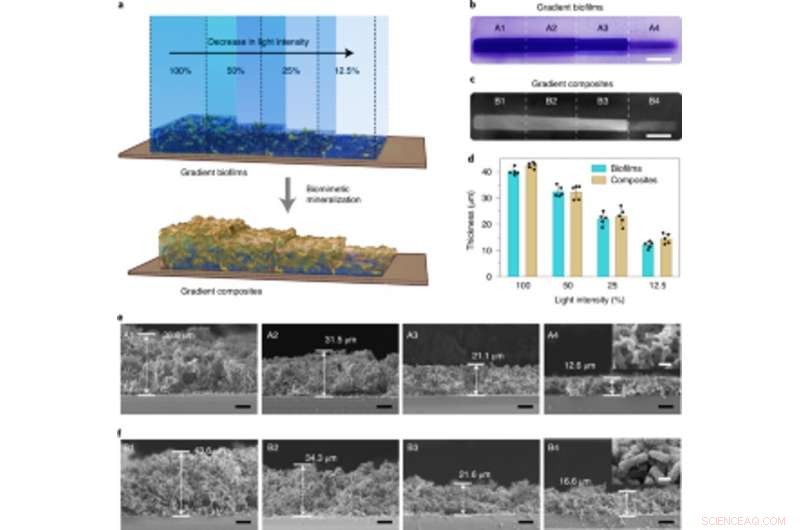 p Mineralização controlável por densidade em biofilmes gradientes regulados por intensidade de luz usados para fabricar compósitos graduados vivos. (a) Ilustração esquemática que mostra a geração de compostos gradientes vivos através da mineralização in situ de biofilmes com densidades de biomassa gradiente. Os biofilmes gradientes foram formados projetando luz com intensidades variadas e controle espacial preciso na placa de Petri contendo a cepa lightreceiver-CsgA-Mfp3S-pep suspensa no meio. (b) Imagem de câmera digital mostrando biofilmes corados com CV com densidades de biomassa gradiente. Barra de escala, 1 cm. (c) Imagem de câmera digital de compósitos vivos em gradiente subsequentemente formados após a mineralização de HA. Barra de escala, 1 cm. (d) A espessura dos biofilmes e dos compósitos mineralizados subsequentemente formados sob diferentes intensidades de luz. Os resultados são apresentados como média ± dp. Os dados são representativos de n =5 experimentos independentes. (e) Micrografias SEM seccionais mostrando as morfologias de diferentes regiões (A1-A4) nos biofilmes com graduação de intensidade de luz. Barras de escala, 10 µm. A imagem inserida (tirada da região A4) representa a morfologia de superfície típica de biofilmes. Barra de escala, 1 µm. (f) Micrografias SEM seccionais mostrando as morfologias de diferentes regiões (B1-B4) nos compostos de gradiente vivo conforme modelado por andaimes de biofilme com intensidade de luz graduada. Barras de escala, 10 µm. A imagem inserida (tirada da região B4) representa a morfologia da superfície típica dos compostos de gradiente mineralizado. Barra de escala, 1 µm. Observe que as porcentagens de opacidade de 100%, 50%, 25% e 12,5% correspondem às intensidades reais de luz de 0,0306 W cm − 2, 0,0268 W cm − 2, 0,0178 W cm − 2 e 0,0140 W cm − 2, respectivamente. Crédito: Nature Chemical Biology , doi:10.1038 / s41589-020-00697-z
Formando compostos vivos controlados
p Mineralização controlável por densidade em biofilmes gradientes regulados por intensidade de luz usados para fabricar compósitos graduados vivos. (a) Ilustração esquemática que mostra a geração de compostos gradientes vivos através da mineralização in situ de biofilmes com densidades de biomassa gradiente. Os biofilmes gradientes foram formados projetando luz com intensidades variadas e controle espacial preciso na placa de Petri contendo a cepa lightreceiver-CsgA-Mfp3S-pep suspensa no meio. (b) Imagem de câmera digital mostrando biofilmes corados com CV com densidades de biomassa gradiente. Barra de escala, 1 cm. (c) Imagem de câmera digital de compósitos vivos em gradiente subsequentemente formados após a mineralização de HA. Barra de escala, 1 cm. (d) A espessura dos biofilmes e dos compósitos mineralizados subsequentemente formados sob diferentes intensidades de luz. Os resultados são apresentados como média ± dp. Os dados são representativos de n =5 experimentos independentes. (e) Micrografias SEM seccionais mostrando as morfologias de diferentes regiões (A1-A4) nos biofilmes com graduação de intensidade de luz. Barras de escala, 10 µm. A imagem inserida (tirada da região A4) representa a morfologia de superfície típica de biofilmes. Barra de escala, 1 µm. (f) Micrografias SEM seccionais mostrando as morfologias de diferentes regiões (B1-B4) nos compostos de gradiente vivo conforme modelado por andaimes de biofilme com intensidade de luz graduada. Barras de escala, 10 µm. A imagem inserida (tirada da região B4) representa a morfologia da superfície típica dos compostos de gradiente mineralizado. Barra de escala, 1 µm. Observe que as porcentagens de opacidade de 100%, 50%, 25% e 12,5% correspondem às intensidades reais de luz de 0,0306 W cm − 2, 0,0268 W cm − 2, 0,0178 W cm − 2 e 0,0140 W cm − 2, respectivamente. Crédito: Nature Chemical Biology , doi:10.1038 / s41589-020-00697-z
Formando compostos vivos controlados
p Com base na natureza sensível à luz dos biofilmes projetados, Wang et al. formação de biofilme manipulado no espaço-tempo para controlar a formação de compósitos. Eles conseguiram isso iluminando um padrão de folha em culturas de bactérias líquidas em placas de petri de poliestireno que recapitulavam fielmente o padrão de luz projetado nos biofilmes bacterianos. Após 7 dias de mineralização, o composto gerado nas placas de Petri manteve o padrão original, conforme observado por meio de microscopia eletrônica de varredura. A abordagem regulada por luz controlou a forma do composto com base em projeções de padrão de grade e resolução espacial de luz em microescala - comparável ao tamanho das bactérias vivas. A equipe então verificou a viabilidade do live, células intactas por meio da engenharia de compostos vivos para expressar proteínas fluorescentes, como confirmado usando imagens de microscopia confocal. Depois disso, eles usaram a análise termogravimétrica para quantificar os componentes inorgânicos de compósitos mineralizados, onde o material inorgânico aumentou proporcionalmente com o tempo de imersão em fluido corporal simulado (SBF). Wang et al. também comparou o módulo de Young do biofilme usando uma técnica de micro-indentação para mostrar como a mineralização fortaleceu os biofilmes de E. coli para proteger as células.
p
Compostos de gradiente de densidade controlada
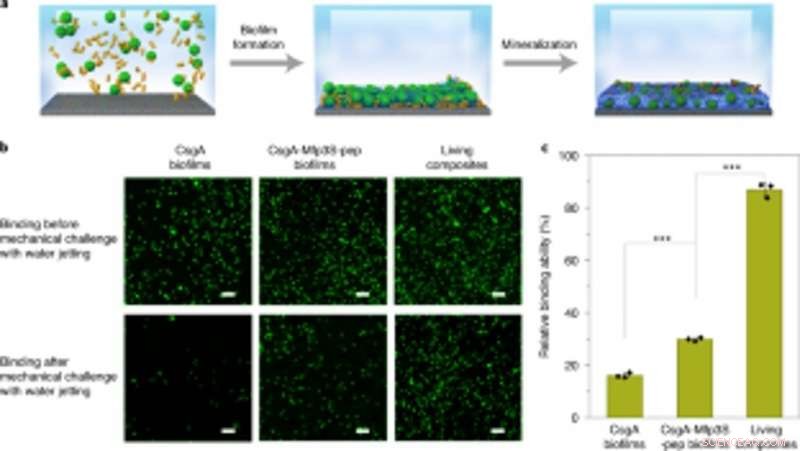 p Acoplamento de biofilmes projetados com mineralização para captura e imobilização robustas de microesferas em substratos. (a) Esquema mostrando a captura e imobilização de microesferas em uma lâmina de vidro em solução. Microesferas de PS suspensas em meio de cultura foram capturadas e imobilizadas em um substrato através da formação de biofilme seguida de mineralização em 1,5 × fluido corporal simulado (SBF). (b) Imagens fluorescentes mostrando os dois tipos de biofilmes (colunas esquerda e central) e microesferas imobilizadas de compósito vivo (coluna direita) nos substratos antes (superior) e após (inferior) desafio com jato de água a uma pressão de descarga constante de 8 psi. Barras de escala, 100 µm. (c) Quantificação das capacidades relativas de diferentes biofilmes e compósitos vivos para colar e imobilizar microesferas de PS no substrato. Os resultados são apresentados como média ± dp. Da esquerda para a direita:P =0,00003, P =0,000004. * P <0,05, ** P <0,01, *** P <0,001. As estatísticas são derivadas usando um teste t bilateral. Os dados são representativos de n =3 experimentos independentes. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
p Acoplamento de biofilmes projetados com mineralização para captura e imobilização robustas de microesferas em substratos. (a) Esquema mostrando a captura e imobilização de microesferas em uma lâmina de vidro em solução. Microesferas de PS suspensas em meio de cultura foram capturadas e imobilizadas em um substrato através da formação de biofilme seguida de mineralização em 1,5 × fluido corporal simulado (SBF). (b) Imagens fluorescentes mostrando os dois tipos de biofilmes (colunas esquerda e central) e microesferas imobilizadas de compósito vivo (coluna direita) nos substratos antes (superior) e após (inferior) desafio com jato de água a uma pressão de descarga constante de 8 psi. Barras de escala, 100 µm. (c) Quantificação das capacidades relativas de diferentes biofilmes e compósitos vivos para colar e imobilizar microesferas de PS no substrato. Os resultados são apresentados como média ± dp. Da esquerda para a direita:P =0,00003, P =0,000004. * P <0,05, ** P <0,01, *** P <0,001. As estatísticas são derivadas usando um teste t bilateral. Os dados são representativos de n =3 experimentos independentes. Crédito: Nature Chemical Biology , doi:https://doi.org/10.1038/s41589-020-00697-z
p As abordagens de engenharia de tecidos enfatizaram a necessidade de identificar precisamente entre os tecidos duros e moles para um desempenho fisiológico bem-sucedido, portanto, a intensidade da luz pode ser ajustada para controlar a densidade e as propriedades mecânicas dos materiais vivos projetados. Zhang et al. conseguiu isso expondo culturas de E. coli a diferentes intensidades de iluminação para revelar como a espessura do biofilme diminuía com a diminuição da intensidade da luz azul. Eles mostraram ainda como a mineralização era fortemente e localmente dirigida pelas proteínas de fusão Mfsp3S-pep projetadas. Em seguida, eles estudaram as propriedades mecânicas locais de regiões iluminadas com micro-indentação para observar um aumento de quatro vezes no módulo de Young para destacar compósitos vivos projetados com gradientes minerais ajustáveis e propriedades mecânicas para interfaces regenerativas de tecido para osso em aplicações de engenharia de tecido ósseo.
p
Implantando compostos vivos para reparo de danos específicos do local
p Os cientistas também estudaram a capacidade dos biofilmes projetados se agregarem para reparar danos por colagem de microesferas de poliestireno, ao lado da mineralização de HA. Como prova de conceito, eles aplicaram compostos mineralizados vivos para preencher e reparar rachaduras projetadas na superfície de uma placa de Petri de poliestireno. Durante os experimentos, os biofilmes adesivos induzidos pela luz capturaram microesferas em solução para preencher o sulco danificado propositalmente criado, enquanto as nanofibras em biofilmes atuaram como um modelo para a mineralização da hidroxiapatita para consolidar a cimentação induzida pela luz sob iluminação de luz azul. Usando microscopia eletrônica de varredura, Wang et al. mostrou como as bactérias e a matriz extracelular circundante aderiram junto com microesferas para ilustrar a função adesiva dos biofilmes vivos. Os compósitos mineralizados com HA formaram-se densamente, camadas semelhantes a concreto que preencheram o sulco danificado para destacar a funcionalidade de mineralização dos compostos vivos para maior durabilidade e aplicações de reparo.
p
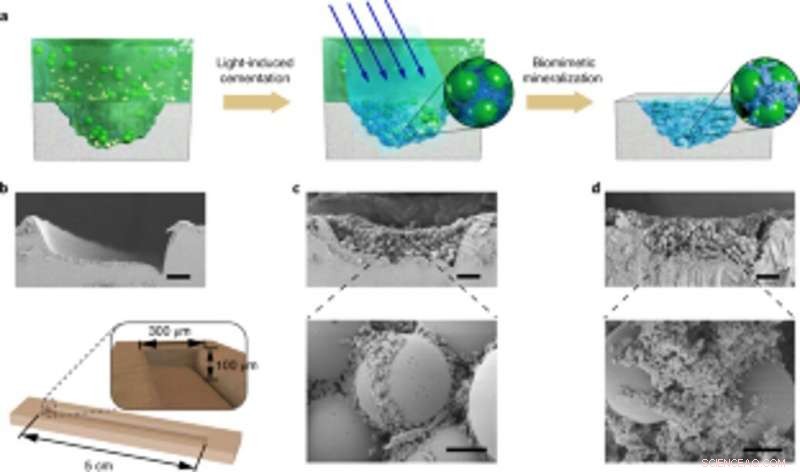 p Aplicação de mineralização viva controlável para reparos de danos específicos do local. (a) Esquema mostrando a aplicação de compósitos mineralizados vivos para preencher e reparar rachaduras na superfície de uma placa de PS Petri. Da esquerda para a direita:sulco de danos no substrato da placa de Petri, biofilmes adesivos induzidos por luz capturam microesferas em solução para preencher o sulco danificado, e nanofibras em biofilmes atuam como um modelo para a mineralização de HA para consolidar o cimento. (b) Imagem SEM mostrando o sulco danificado. Abaixo, um diagrama esquemático que ilustra as dimensões do sulco de dano. Barra de escala, 50 µm. c, Imagens de SEM mostrando a morfologia do sulco de dano preenchido com o biofilme e microesferas. Barras de escala:50 µm (topo), 5 µm (parte inferior). (d) Imagens SEM mostrando a morfologia do sulco de dano após a mineralização; HA preenche as lacunas entre as esferas. Barras de escala:50 µm (topo), 5 µm (parte inferior). Observe que os experimentos de reparo de danos específicos do local foram repetidos pelo menos três vezes com resultados idênticos. Crédito: Nature Chemical Biology , doi:10.1038 / s41589-020-00697-z
Panorama
p Aplicação de mineralização viva controlável para reparos de danos específicos do local. (a) Esquema mostrando a aplicação de compósitos mineralizados vivos para preencher e reparar rachaduras na superfície de uma placa de PS Petri. Da esquerda para a direita:sulco de danos no substrato da placa de Petri, biofilmes adesivos induzidos por luz capturam microesferas em solução para preencher o sulco danificado, e nanofibras em biofilmes atuam como um modelo para a mineralização de HA para consolidar o cimento. (b) Imagem SEM mostrando o sulco danificado. Abaixo, um diagrama esquemático que ilustra as dimensões do sulco de dano. Barra de escala, 50 µm. c, Imagens de SEM mostrando a morfologia do sulco de dano preenchido com o biofilme e microesferas. Barras de escala:50 µm (topo), 5 µm (parte inferior). (d) Imagens SEM mostrando a morfologia do sulco de dano após a mineralização; HA preenche as lacunas entre as esferas. Barras de escala:50 µm (topo), 5 µm (parte inferior). Observe que os experimentos de reparo de danos específicos do local foram repetidos pelo menos três vezes com resultados idênticos. Crédito: Nature Chemical Biology , doi:10.1038 / s41589-020-00697-z
Panorama
p Desta maneira, Yanyi Wang e seus colegas produziram compostos vivos padronizados com bioinspiração e compostos vivos classificados com uma plataforma de biofilme regulada por luz. As composições resultantes exibiram capacidade de resposta ambiental semelhante a suas contrapartes nativas. As células dentro dos compósitos permaneceram viáveis e responderam aos estímulos ambientais mesmo após a mineralização. O trabalho abre um caminho para a criação de vida, compostos orgânicos-inorgânicos funcionais com recursos adaptativos e autorreparáveis com aplicações em biomedicina, Medicina regenerativa, e biorremediação. p © 2020 Science X Network




