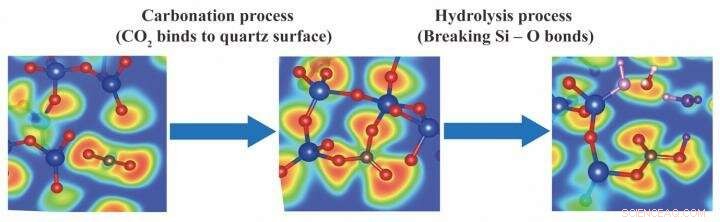
A cor vermelha denota que a probabilidade de ocorrência de elétrons de valência é de 100 por cento, a cor azul significa que não existem elétrons na área, e a cor verde significa gás-elétron livre indicando a fronteira das ligações covalentes. Vermelho, bolas azuis e marrons representam oxigênio, átomos de silício e carbono, respectivamente. Crédito:International Institute for Carbon Neutral Energy Research (I²CNER), Universidade Kyushu
A humanidade precisa melhorar quando se trata de reduzir as emissões de carbono para evitar os piores efeitos das mudanças climáticas. Se o mundo quiser cumprir a meta mínima do IPCC de manter os aumentos de temperatura global abaixo de 1,5 ° C, todos os caminhos possíveis para CO 2 remediação deve ser explorada.
A captura geológica pode desempenhar um papel importante aqui. As rochas e sedimentos subterrâneos do nosso planeta oferecem um vasto espaço potencial para o armazenamento de carbono a longo prazo. Para apoiar isso, um estudo computacional recente de um grupo internacional liderado por japoneses na Universidade de Kyushu mostra como o dióxido de carbono aprisionado pode ser convertido em minerais inofensivos.
As rochas abaixo da superfície da Terra são altamente porosas, e o aprisionamento envolve a injeção de CO 2 nos poros após coletá-lo de sua fonte de emissão. Embora CO 2 geralmente é considerado muito estável para reagir quimicamente com a rocha, ele pode se ligar firmemente à superfície por adsorção física. Eventualmente, ele se dissolve na água, formando ácido carbônico, que pode reagir com metais aquosos para formar minerais de carbonato.
"A mineralização é o método mais estável de CO de longo prazo 2 armazenar, bloqueio CO 2 em uma forma completamente segura que não pode ser reemitida, "explica Jihui Jia, do Instituto Internacional de Pesquisa de Energia Neutra em Carbono (I 2 CNER), Universidade Kyushu, primeiro autor do estudo. "Antigamente, pensava-se que isso levaria milhares de anos, mas essa visão está mudando rapidamente. As reações químicas não são totalmente compreendidas porque são muito difíceis de reproduzir em laboratório. É aqui que entra a modelagem. "
Conforme relatado em The Journal of Physical Chemistry C , simulações foram feitas inicialmente para prever o que acontece quando o dióxido de carbono colide com uma superfície de quartzo clivada - quartzo (SiO 2 ) sendo abundante na crosta terrestre. Quando as trajetórias de simulação foram reproduzidas, o CO 2 moléculas foram vistas dobrando-se de sua forma linear O =C =O para formar CO trigonal 3 unidades ligadas com o quartzo.
Em uma segunda rodada de simulações, H 2 Moléculas O foram adicionadas para imitar a "formação de água" que frequentemente está presente abaixo dos locais de perfuração de petróleo e gás. Curiosamente, o H 2 As moléculas O atacaram espontaneamente o CO reativo 3 estruturas, quebrar as ligações Si-O para produzir íons carbonato. Assim como o ácido carbônico, íons de carbonato podem reagir com cátions metálicos dissolvidos (como Mg 2 + , Ca 2 + , e Fe 2 + ) para ligar o carbono permanentemente à forma mineral.
Juntos, as simulações mostram que ambas as etapas do CO 2 mineralização - carbonatação (ligação à rocha) e hidrólise (reação com água) - são favoráveis. Além disso, íons de carbonato livre podem ser feitos por hidrólise, não apenas pela dissociação do ácido carbônico, como antes se supunha. Essas percepções se basearam em uma forma sofisticada de dinâmica molecular que modela não apenas as colisões físicas entre átomos, mas a transferência de elétrons, a essência da química.
"Nossos resultados sugerem algumas maneiras de melhorar a captura geológica, "diz o autor principal do estudo, Takeshi Tsuji." Para quartzo capturar CO 2 , deve ser uma superfície clivada, portanto, os átomos de silício e oxigênio têm ligações reativas 'oscilantes'. Na vida real, Contudo, a superfície pode ser protegida por ligações de hidrogênio e cátions, o que impediria a mineralização. Precisamos de uma maneira de remover esses cátions ou desidrogenar a superfície. "
Estão crescendo as evidências de que o CO capturado 2 pode mineralizar muito mais rápido do que se acreditava anteriormente. Embora seja empolgante, o artigo Kyushu destaca o quão complexa e delicada a química pode ser. Por enquanto, o grupo recomenda mais estudos em outras rochas abundantes, como basalto, para mapear o papel que a armadilha geoquímica pode desempenhar no maior desafio técnico que a civilização enfrenta.