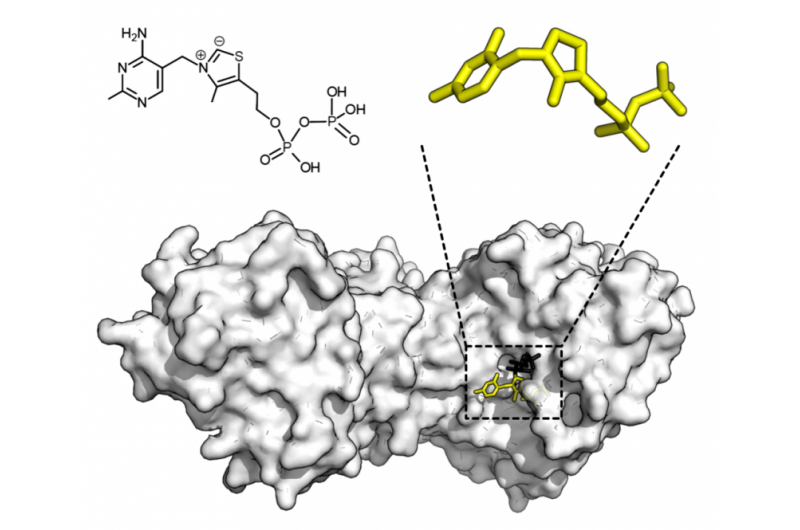
 p Estrutura química do pirofosfato de tiamina e estrutura da proteína da transcetolase. Cofator pirofosfato de tiamina em amarelo e substrato 5-fosfato de xilulose em preto. Crédito:Thomas Shafee / Wikipedia
p Estrutura química do pirofosfato de tiamina e estrutura da proteína da transcetolase. Cofator pirofosfato de tiamina em amarelo e substrato 5-fosfato de xilulose em preto. Crédito:Thomas Shafee / Wikipedia
p Os cientistas quebraram as regras da engenharia enzimática para desbloquear um novo método para a criação de reações químicas que poderiam desbloquear uma ampla gama de novas aplicações - desde a criação de novos medicamentos até a produção de alimentos. p Em seu artigo publicado hoje em
Catálise Natural , A professora Francesca Paradisi e a Dra. Martina Contente da University of Nottingham e da University of Bern mostram um novo método para produzir moléculas químicas com mais eficiência por meio de uma nova reação de uma etapa na enzima.
p O Professor Paradis é Professor de Biocatálise na Escola de Química de Nottingham e Professor de Química Farmacêutica na Universidade de Berna, ela explica:"Demonstramos como uma mutação muito simples em um dos resíduos-chave de uma enzima útil expandiu dramaticamente seu escopo sintético, permitindo o uso da variante mutante na preparação de moléculas químicas desafiadoras, bem como metabólitos naturais que são vitais em muitos processos biológicos do corpo. "
p Qualquer livro sobre enzimas relatará como os aminoácidos catalíticos em qualquer família de enzimas são altamente conservados, são na verdade uma assinatura do tipo de química que uma enzima pode fazer. Variações ocorrem e, em alguns casos, se o aminoácido substituto for semelhante, ambos podem ser encontrados em proporção significativa na Natureza, mas outros podem ser muito menos comuns e são encontrados apenas em um número limitado de espécies.
p "Neste estudo, exploramos uma área intocada da engenharia de enzimas e modificamos o resíduo catalítico fundamental no sítio ativo de uma enzima, "acrescenta o professor Paradisi." Anteriormente, pensava-se que fazer isso causaria uma perda de atividade da enzima, mas descobrimos que este não é o caso quando este biocatalisador é usado em uma direção sintética e, de fato, moléculas desafiadoras, mas muito úteis agora podem ser feito em condições moderadas que podem ser facilmente ampliadas e replicadas comercialmente para uso em uma ampla gama de produtos. "
p Para alterar o escopo do substrato de uma enzima, a abordagem geralmente tem sido transformar os resíduos envolvidos no reconhecimento do substrato, seja por meio de design racional ou evolução direcionada, deixando sempre intocados os catalíticos.
p A variante mutante de uma enzima aciltransferase foi criada rapidamente e enquanto o biocatalisador nativo trabalharia com álcoois e aminas lineares, o mutante trabalha com tióis e aminas muito mais complexas também. A pesquisa demonstrou que, de fato, a nova variante perdeu a capacidade de hidrolisar ésteres, mas para aplicações sintéticas, onde um éster ou outros grupos funcionais precisam ser feitos (tioésteres e amidas) e não clivados, esta é de fato uma grande vantagem.
p A Dra. Martina Contente acrescenta, "Recebemos um feedback fantástico da comunidade científica sobre este estudo, pois ele está fornecendo uma nova ferramenta para a química que pode ser aplicada a uma ampla gama de reações moleculares. O fato de ser uma reação muito estável criada sem a necessidade de condições específicas significa que tem potencial para uma aplicação comercial de baixo custo na produção de novos produtos farmacêuticos. Acreditamos ter desbloqueado uma nova combinação nas tríades catalíticas que a natureza parece ter desfavorecido, possivelmente para apertar o controle da reatividade, mas isso para um químico pode ser uma verdadeira mina de ouro. "
