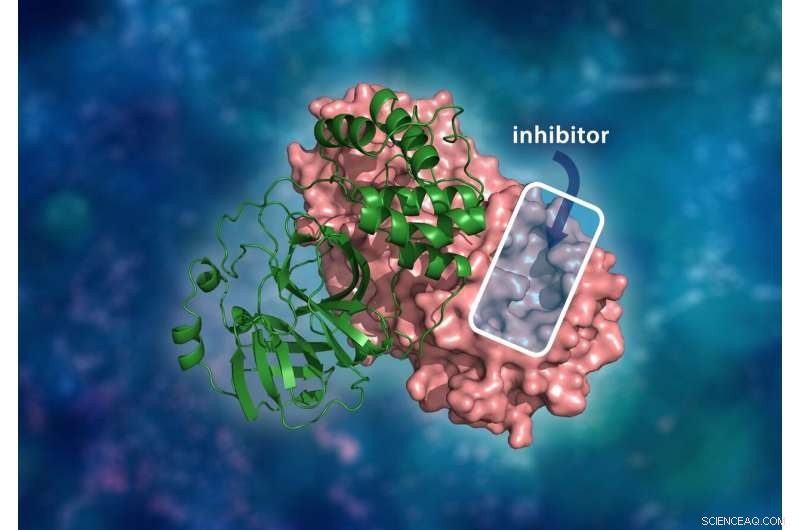
A estrutura tridimensional da protease principal SARS-CoV-2. O complexo de dímero molecular consiste em um único monômero (verde) ligado a outro monômero (rosa), onde um inibidor da droga se ligaria a uma cavidade catalítica para impedir a replicação do vírus. Crédito:ORNL / Andrey Kovalevsky, Jill Hemman
À medida que o novo coronavírus continua a se espalhar, pesquisadores estão procurando novas maneiras de pará-lo. Mas para dois cientistas, olhar para o futuro significa buscar inspiração no passado.
Em janeiro de 2020, Andrey Kovalevsky e Daniel Kneller, pesquisadores do Laboratório Nacional de Oak Ridge (ORNL) do Departamento de Energia (DOE), estavam se preparando para usar nêutrons para estudar a relação entre uma certa protease do HIV - uma proteína enzimática que permite ao vírus se replicar no corpo humano - e uma classe de medicamentos anti-retrovirais conhecidos como inibidores da protease do HIV. Alguns tipos de HIV criam resistência a esses medicamentos. O objetivo dos pesquisadores era obter uma melhor compreensão de como as variações de protease funcionam, para ajudar no desenvolvimento de tratamentos de ponta para superar até mesmo as mais resistentes cepas de HIV.
Quando a equipe começou seu trabalho, eles não sabiam disso, coincidentemente, seus esforços para estudar o HIV os colocaria rapidamente em um novo caminho para combater o COVID-19, a pandemia que agora domina o mundo.
Acontece que a atividade enzimática da protease que permite a reprodução do HIV - o próprio mecanismo que a equipe de Kovalevsky estava preparando para investigar com nêutrons - é o mesmo mecanismo de replicação empregado pelo SARS-CoV-2, o vírus que causa a doença COVID-19.
Agora, a equipe mudou o foco da abordagem experimental que pretendiam usar para estudar o HIV para combater a nova ameaça global.
Os estudos de HIV giram em torno de um novo coronavírus
Kovalevsky estuda o HIV há 15 anos. Como cristalógrafo de nêutrons, ele estuda pequenas amostras cristalizadas de matéria biológica, bombardeando-as com nêutrons. A técnica de espalhamento de nêutrons é altamente eficaz em revelar como a estrutura atômica de uma amostra está organizada e como seus átomos estão se comportando. Dependendo do objetivo, os insights coletados podem oferecer orientação sobre como melhorar ou mesmo suprimir certas propriedades de um material biológico.
Os nêutrons são uma ferramenta ideal para estudar estruturas e comportamentos biológicos por causa de sua sensibilidade aguda a elementos leves como o hidrogênio e sua capacidade de sondar esses materiais sem danificá-los.
Em 2019, Kovalevsky começou a estudar o HIV de uma forma nunca antes feita. O uso de espalhamento inelástico de nêutrons permitiria a ele coletar dados sobre a dinâmica, ou os movimentos, de uma protease de HIV, o que aumentaria os dados de difração de nêutrons que ele vinha coletando há anos. Ter as informações estruturais e comportamentais - ou dinâmicas - forneceria uma imagem mais completa de como o vírus funciona e, por sua vez, pode levar a novos avanços nos tratamentos.
Depois de usar o espectrômetro VISION na Spallation Neutron Source (SNS) - um instrumento de espalhamento de nêutrons que revela os movimentos dos átomos com base em suas vibrações - Kovalevsky percebeu que precisava de ajuda para analisar os dados.
"Daniel traz experiência em pesquisa de protease viral, "explicou Kovalevsky sobre o recrutamento de Kneller." Ele sabe como trabalhar com as proteínas no laboratório. Ele conhece todas as técnicas de laboratório em termos de produção de proteínas, purificação, cristalização, coleta de dados cristalográficos, e análise para obter insights sobre o design de drogas. "
Demorou cerca de 8 meses para contratar Daniel após uma extensa pesquisa, Kovalevsky diz. Kneller - que se especializou no estudo da protease do HIV usando cristalografia - juntou-se à equipe de Kovalevsky em janeiro de 2020 para ajudar no trabalho experimental e computacional da protease do HIV.
Mas assim que a equipe estava pronta para mergulhar, COVID-19 tornou-se global, e a pesquisa chegou a um ponto final.

O pesquisador de pós-doutorado Daniel Kneller está usando o Centro de Biologia Estrutural e Molecular do ORNL para sintetizar proteínas cristalizadas relacionadas ao COVID-19 e prepará-las para estudos de espalhamento de nêutrons na Fonte de Nêutrons de Espalação e no Reator Isotópico de Alto Fluxo. Crédito:ORNL / Carlos Jones
Mudando de marcha, obtendo resultados iniciais
Em março, a equipe da área de Ciências de Nêutrons do ORNL desenvolveu um plano para estudar os principais componentes do COVID-19, reunindo equipes de pesquisa e redefinindo a prioridade dos cronogramas de operação de instrumentos essenciais nas duas instalações de espalhamento de nêutrons do ORNL, SNS e o reator de isótopos de alto fluxo (HFIR).
Já tendo estabelecido as bases para estudar a protease, Kovalevsky e Kneller prontamente mudaram do HIV para o novo coronavírus. Especificamente, eles estão atualmente focados na protease principal do SARS-CoV-2, o vírus que causa a doença COVID-19.
"A protease SARS-CoV-2 é uma enzima que corta proteínas que permitem a reprodução do vírus. Entender como a protease é montada e como ela funciona é um primeiro passo crítico para encontrar inibidores de drogas eficazes para bloquear o mecanismo de replicação do vírus, "disse Kovalevsky." Semelhante à protease do HIV, a principal protease do vírus SARS-CoV-2 é um dos alvos de drogas mais atraentes no momento para o desenvolvimento de inibidores específicos. "
Tal como acontece com o plano original do trabalho de HIV, a equipe está se preparando para usar instrumentos em SNS e HFIR para obter insights fundamentais sobre como os átomos na protease são organizados. Usando os instrumentos MaNDi e IMAGINE, os pesquisadores serão capazes de juntar as peças da estrutura atômica da protease usando nêutrons para rastrear os átomos de hidrogênio nas amostras de proteínas cristalizadas.
Mas primeiro, eles precisam obter cristais de alta qualidade, grandes o suficiente para experimentos com nêutrons. É aqui que a equipe fez avanços significativos desde o início.
A qualidade do cristal é determinada primeiro pela forma como eles difratam, ou espalhar, Raios X. Tipicamente, este processo é conduzido em uma instalação síncrotron, onde os cristais podem ser congelados a cerca de 100 K (ou cerca de -280 ° F).
A equipe usou o laboratório de Cristalização e Caracterização de Proteínas no SNS para cultivar cristais de protease SARS-CoV-2, o que levou cerca de uma semana a 10 dias. Para analisar a qualidade dos cristais, eles usaram a máquina de raio-X local, um Rigaku HighFlux HomeLab, que forneceu várias descobertas importantes.
Primeiro, os experimentos de raios-X confirmaram que os cristais eram de alta qualidade e que o método usado para cultivá-los pode produzir cristais maiores adequados para experimentos de nêutrons. Segundo, ter uma máquina local permitiu-lhes coletar medições de raios-X em temperatura ambiente, em torno de 70 ° F.
As medições de temperatura ambiente permitiram-lhes observar a plasticidade, ou flexibilidade, da estrutura da protease, fornecer informações discerníveis sobre como a estrutura se comporta em condições próximas ao ambiente fisiológico do vírus. Esses dados não poderiam ter sido obtidos usando amostras congeladas.
"Este é um marco importante em nosso esforço para fazer difração de nêutrons. O investimento em uma máquina de raio-X local valeu a pena, "disse Kneller." Em uma instância, cultivamos cristais na segunda-feira e coletamos dados sobre eles na terça-feira. De outra forma, para obter essa informação você teria que enviar seus cristais para um síncrotron, o que pode levar de dias a semanas. "
"E neste momento, por causa da pandemia, você não pode ir para um síncrotron, "acrescentou Kovalevsky." E para analisar os cristais à temperatura ambiente, Você tem que estar lá."
"As informações que aprendemos com a estrutura de temperatura ambiente têm a capacidade de impactar imediatamente as direções computacionais que os pesquisadores estão usando. Encontramos algumas diferenças entre nossa estrutura quase fisiológica em temperatura ambiente e as estruturas congeladas dos síncrotrons, o que pode ser importante para o trabalho computacional, como os estudos de docking de pequenas moléculas sendo feitos no supercomputador Summit do ORNL, "disse Kneller.

Visão microscópica dos cristais de protease SARS-CoV-2 cultivados no laboratório de Cristalização e Caracterização de Proteínas do ORNL. Uma vez que os cristais atingem um certo tamanho e forma, eles serão usados em experimentos de espalhamento de nêutrons para determinar como a protease principal SARS-CoV-2 está estruturada e como ela se comporta. Crédito:ORNL / Daniel Kneller
"Até aqui, tivemos muito sucesso em nossos primeiros estudos do COVID-19. Já enviamos um manuscrito para publicação sobre nossas descobertas estruturais, em que essencialmente conduzimos dois meses de pesquisas que normalmente poderiam ter levado um ano. "
Ajudando Kovalevsky e Kneller na análise de dados e estrutura dos cristais de proteína estava Leighton Coates, um cientista de instrumentos do difratômetro SNS MaNDi, que também é membro da equipe cristalográfica que estuda a protease SARS-CoV-2.
Os dados gerados nos próximos meses serão compartilhados com outros laboratórios nacionais, universidades, e a comunidade científica mais ampla para construir modelos mais precisos para simulações computacionais usadas para identificar candidatos potenciais a drogas para parar o vírus.
"A comunidade científica respondeu rapidamente à pandemia COVID-19. Temos a sorte de poder fazer nossas próprias contribuições, aproveitando anos de experiência no estudo do HIV para construir uma melhor compreensão de como o novo coronavírus se replica e como podemos combatê-lo por inibindo sua protease essencial, "disse Kovalevsky.
Pesquisando a resistência ao HIV
Antes da pandemia voltar sua atenção e esforços para pesquisar SARS-CoV-2, Kovalevsky e Kneller tinham um plano claro para atacar o HIV.
Trinta e nove milhões de pessoas em todo o mundo estão infectadas com o HIV. Oferecer a essas pessoas melhores opções de tratamento não só melhoraria sua qualidade de vida, mas também evitaria que a doença se propagasse ainda mais.
A protease do HIV funciona clivando inofensivos, ou não funcional, filamentos de proteínas em proteínas menores, transformando-os em proteínas virais funcionais que permitem que o vírus se reúna e continue infectando células humanas saudáveis. Em geral, Os inibidores da protease do HIV são bastante eficazes no bloqueio da protease durante a replicação do HIV, mas algumas variações da protease desenvolveram a capacidade de resistir aos inibidores de drogas.
“Se pudermos aprender mais sobre os mecanismos moleculares que tornam as variantes da protease do HIV resistentes aos medicamentos, podemos projetar drogas mais bem equipadas para superar suas defesas, "disse Kneller.
Especificamente, Kneller e Kovalevsky queriam explorar PRS-17, uma variante de protease de HIV única que é 10, 000 vezes menos probabilidade do que outras variantes não resistentes de serem inibidas pelos inibidores clínicos da protease do HIV mais eficazes atualmente disponíveis. Kovalevsky explicou que embora os programas de tratamento do HIV tenham percorrido um longo caminho desde que a pandemia do HIV começou na década de 1980, variantes mutantes como PRS-17, resultante de tratamento prolongado, poderia comprometer anos de inovação e progresso farmacêutico e resultar em terapias antivirais fracassadas.
“A resistência aos medicamentos é agora o maior problema para os pacientes com HIV. Com o tratamento adequado, os pacientes podem ter uma vida longa e feliz com níveis indetectáveis de HIV em seu sistema. Eles não desenvolverão AIDS ou espalharão o HIV para outras pessoas. Mas o PRS-17 e outras variantes da protease do HIV resistentes aos medicamentos tornam difícil para os médicos combater o HIV em seus pacientes, "disse Kovalevsky.
Compreender exatamente como o PRS-17 neutraliza a eficácia dos inibidores da protease do HIV é difícil, dizem os pesquisadores. As proteínas constituintes dos vírus são sistemas complexos, e PRS-17 tem a capacidade de empregar vários mecanismos diferentes para se proteger contra drogas anti-retrovirais.
"Descobrir como o PRS-17 resiste aos inibidores da protease do HIV é um desafio, mas um que absolutamente temos que superar. PRS-17 é um isolado clínico, o que significa que veio de um paciente real lutando para combater esta doença, "explicou Kneller." Aprender mais sobre isso pode salvar a vida de muitos pacientes, porque o conhecimento que ganhamos usando nêutrons em PRS-17 será transferível para outras variantes similares de protease extremamente resistentes aos medicamentos. "
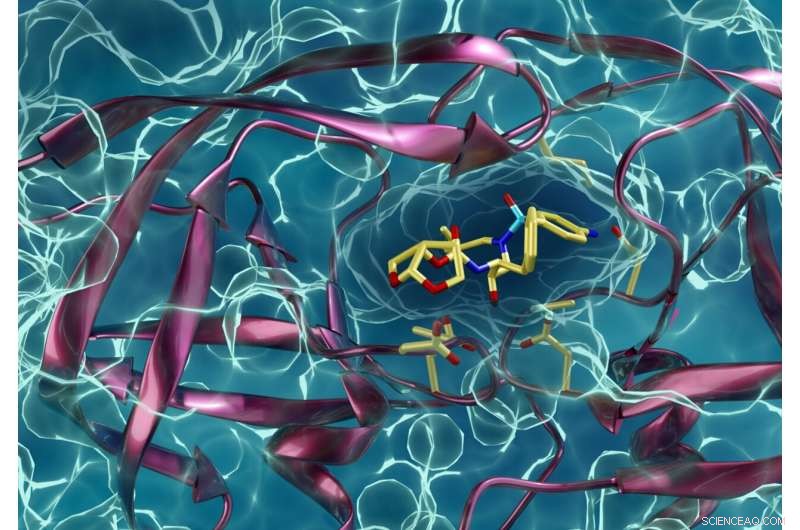
Tipo de protease do HIV resistente a medicamentos que interage com um inibidor da protease do HIV. Kneller e Kovalevsky esperam que as mesmas técnicas que usaram para aprender mais sobre o HIV também ajudem outros pesquisadores na batalha contra o COVID-19. Crédito:ORNL / Jill Hemman
A equipe pretendia criar um mapa da protease PRS-17 para entender melhor os mecanismos moleculares por trás de sua resistência aos medicamentos. Isso envolveu o uso dos instrumentos MaNDi e VISION no SNS e do instrumento IMAGINE no HFIR.
"Era praticamente a mesma abordagem que estamos tentando agora com o COVID-19, "disse Kovalevsky.
Com MaNDi e IMAGINE, Kneller e Kovalevsky planejavam sondar amostras cristalizadas de protease PRS-17 para gerar dados detalhados sobre sua estrutura atômica estática. Usar o VISION permitiria a eles sondar amostras em pó de protease PRS-17 para fornecer insights sobre suas propriedades dinâmicas medindo as vibrações moleculares.
Os nêutrons são particularmente adequados para estudar componentes de vírus como o HIV (ou SARS-CoV-2) devido à sua sensibilidade ao hidrogênio, um componente importante de todas as proteínas. Com cristalografia de nêutrons, a equipe conseguiu localizar com precisão cada átomo de hidrogênio dentro da protease do PRS-17, dando-lhes uma visão sem precedentes sobre como a proteína funciona e quais interações ela sofre com um inibidor de protease.
"Use cristalografia de nêutrons em MaNDi e IMAGINE para localizar átomos de hidrogênio em cristais de protease PRS-17, nos permitiria construir um perfil abrangente de sua estrutura estática, "disse Kneller." Com VISÃO, também rastrearíamos átomos de hidrogênio, mas usaríamos amostras em pó de protease PRS-17 que foram reidratadas para imitar as condições de superlotação de uma partícula viral do HIV. Isso nos permitiria ver suas propriedades dinâmicas e aprender mais sobre como ele pode se mover quando está trabalhando dentro de uma partícula viral. "
Kneller explicou que obter informações sobre as propriedades estáticas e dinâmicas do PRS-17 é importante para o desenvolvimento de uma compreensão completa da resistência desse vírus aos anti-retrovirais.
"Se eu rastreasse sua localização apenas uma vez por dia à meia-noite, Eu acho que você passa todo o seu tempo em casa. Mas realmente, você se move bastante ao longo do dia. É por isso que é importante coletar medidas estáticas e dinâmicas de nossa amostra. Isso nos permite construir uma imagem mais completa do comportamento da protease, "disse Kneller.
"Sem cristalografia de nêutrons, os pesquisadores têm que fazer suposições informadas sobre onde os átomos de hidrogênio estão em uma proteína sempre que tentam entender como a proteína faz seu trabalho, "acrescentou Kneller." Esses tipos de experimentos que Andrey fez anteriormente foram capazes de confirmar a localização desses átomos de hidrogênio em variantes não resistentes da protease do HIV, mas nunca em uma variante de protease extremamente resistente a drogas. Isso significa que seríamos capazes de produzir dados verdadeiramente únicos e novos sobre esta protease. "
Kneller e Kovalevsky esperam um dia gerar dados por meio de seus experimentos que se tornem um recurso inestimável para pesquisadores que buscam combater cepas de HIV resistentes a medicamentos.
"É um esforço de equipe. Químicos, biólogos, e profissionais da indústria farmacêutica devem trabalhar juntos para combater doenças, "disse Kneller." Juntos, podemos desenvolver tratamentos eficazes para cepas de HIV resistentes a medicamentos. "
A pesquisa foi apoiada pelo DOE Office of Science por meio do National Virtual Biotechnology Laboratory, um consórcio de laboratórios nacionais do DOE focado na resposta ao COVID-19, com financiamento fornecido pela Lei Coronavirus CARES.