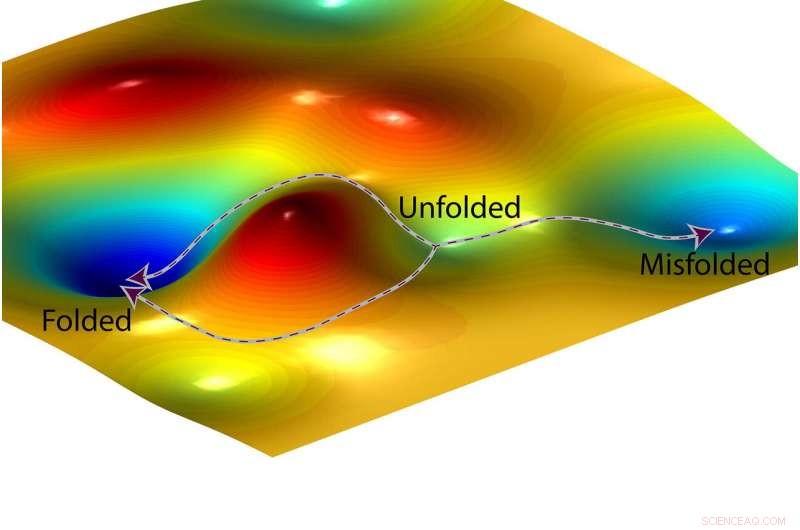
A representação de um artista de uma paisagem de energia livre e dois caminhos possíveis que uma proteína pode seguir (à esquerda) para se dobrar corretamente e um terceiro caminho (à direita) que leva a um estado de dobramento incorreto. Crédito:O. Igoshin / Rice University
Os pesquisadores da Rice University descobriram uma simetria oculta nas equações cinéticas químicas que os cientistas há muito usam para modelar e estudar muitos dos processos químicos essenciais para a vida.
A descoberta tem implicações para o design de drogas, genética e pesquisa biomédica e é descrita em estudo publicado este mês no Proceedings of the National Academy of Sciences . Para ilustrar as ramificações biológicas, co-autores do estudo Oleg Igoshin, Anatoly Kolomeisky e Joel Mallory do Centro de Física Teórica Biológica de Rice (CTBP) usaram três exemplos abrangentes:dobramento de proteínas, catálise enzimática e eficiência da proteína motora.
Em cada caso, os pesquisadores demonstraram que uma razão matemática simples mostra que a probabilidade de erros é controlada pela cinética em vez da termodinâmica.
"Pode ser um enovelamento de proteína na conformação correta versus incorreta, uma enzima que incorpora o aminoácido certo versus o errado na cadeia polipeptídica, ou uma proteína motora dando um passo para trás por engano em vez de ir para frente, "disse Igoshin, investigador do CTBP e professor de bioengenharia da Rice. "Todas essas propriedades podem ser expressas como uma razão de dois fluxos de estado estacionário, e descobrimos que as propriedades biológicas expressas nesses termos estão sob controle cinético. "
O exemplo de dobramento de proteína ilustra as implicações para o design de drogas. Todas as proteínas se dobram em uma forma característica, e uma fração mal dobrada na forma errada. O dobramento incorreto da proteína foi implicado em alguns distúrbios e doenças genéticas hereditárias, e os fabricantes de medicamentos estão interessados em fazer medicamentos que possam reduzir as chances de proteínas de dobramento incorreto.
Antes de dobrar, uma proteína tem energia, como uma bola no topo de uma colina. Dobrar é a corrida em declive deste ponto inicial de alta energia até o local onde a bola para de rolar. Os químicos costumam usar um auxílio visual chamado "paisagem de energia livre" para mapear os níveis de energia em reações químicas. A paisagem parece uma cadeia de montanhas com picos e vales, e a descida desde o ponto inicial desdobrado de uma proteína até seu ponto final totalmente dobrado pode parecer uma estrada de montanha que serpenteia por uma série de vales. Mesmo que uma cidade ao longo da estrada tenha uma altitude mais baixa, um viajante pode ter que escalar colinas para ir de um vale a outro no caminho de descida.
"Mostramos que são as barreiras, os pontos altos entre os vales, que determinam essas proporções, - disse Igoshin. - As profundezas dos vales não importam.
"Se você deseja obter um medicamento que ajude uma proteína a se dobrar corretamente, por exemplo, nossa previsão é que a droga deve ser capaz de reduzir uma barreira ao longo da via de dobramento, "disse ele." Se isso afeta apenas os vales, digamos, melhorando a estabilidade de algumas conformações intermediárias ao longo da via de dobramento, não vai mudar a proporção de vezes que a proteína se dobra corretamente e incorretamente. "
Igoshin disse que o trabalho resultou de um estudo de 2017 onde ele, Kolomeisky e o ex-pesquisador de pós-doutorado do CTBP, Kinshuk Banerjee, mostraram que a precisão da catálise enzimática foi controlada cineticamente. Igoshin descreveu a descoberta como um "tipo de simetria de equações subjacente".
"Se você olhar para as proporções dos fluxos, você obtém este cancelamento interessante, e todos os termos que têm a ver com esses valores se cancelam, e você obtém a invariância, "disse ele." Quando obtivemos este resultado, parecia contra-intuitivo para nós. Então, não tínhamos certeza se era uma coincidência, porque no artigo anterior nós o mostramos para apenas dois esquemas cinéticos particulares. Agora, o trabalho de Joel mostrou que ele pode ser generalizado para essa ampla gama de sistemas. "
Igoshin disse que a simetria "não era tão difícil de provar, mas ninguém percebeu antes. "
"Acho que é um resultado físico muito interessante que tem grandes implicações na biologia, "Ele disse." Isso poderia ajudar a definir os limites do que é possível em termos de controle e otimização de propriedades de nível de sistema em muitos processos biológicos. "