A lógica do projeto FESS, implementação, e aplicação. (A) Esquema da via de entrega de informações do biomarcador habilitada pelo FESS, ilustrando a amostragem, de detecção, e roteamento de informações de biomarcadores recuperadas epidérmicamente para leitura eletrônica por meio de uma única entidade. (B) Fundamentação do projeto do FESS. (C) Implementação representativa do FESS, demonstrando flexibilidade e nenhuma interconexão no plano. (D) Família representativa de dispositivos FESS, contendo 1 × 2, 3 × 3, e arranjos de eletrodos 6 × 6. (E) Smartwatch desenvolvido sob medida e habilitado para FESS para monitoramento de biomarcadores. (F e G) Implantação do smartwatch habilitado para FESS em configurações estacionárias (F) e exercícios de alta intensidade (G). (Foto:Peterson Nguyen, Kaili Chiu, Yichao Zhao, Universidade da Califórnia, Los Angeles.) Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aaz0007
Em um novo estudo publicado em Avanços da Ciência , Yichao Zhao e uma equipe de pesquisa em bioeletrônica integrada e materiais e engenharia nos EUA projetaram um descartável, sistema de detecção eletroquímica autônomo (FESS). O FESS permitiu que eles realizassem uma estratégia de design em nível de sistema para enfrentar os desafios dos biossensores vestíveis na presença de movimento e permitir uma integração perfeita com os eletrônicos de consumo. A equipe desenvolveu um smartwatch habilitado para FESS, apresentando amostras de suor, detecção eletroquímica e exibição ou transmissão de dados, dentro de uma plataforma vestível independente. A equipe usou o FESS-smartwatch para monitorar os perfis dos metabólitos do suor entre indivíduos sedentários e em ambientes de exercícios intensos.
A infraestrutura da Internet das coisas (IOT) pode ser usada em eletrônicos de consumo vestíveis para transformar a medicina personalizada e de precisão ao coletar dados fisiologicamente relevantes com intervenção mínima do usuário. Os cientistas costumam usar sensores físicos em plataformas vestíveis comerciais para rastrear a atividade física e os sinais vitais de um usuário. Contudo, para obter uma visão sobre a química dinâmica do corpo, os pesquisadores exigem superfícies de detecção eletroquímica para direcionar as moléculas do biomarcador dentro de fluidos corporais recuperados de forma não invasiva, como o suor. Para conseguir isso, é fundamental projetar com precisão o caminho de entrega de informações da pele para uma unidade de leitura. Para detecção eletroquímica, a via de entrega de informações deve amostrar e entregar o biofluido rico em biomarcador para a superfície do sensor em uma estrutura microfluídica, seguido pela transdução de sinal através de elementos interconectados para a eletrônica de leitura. O sinal deve ser mantido ao longo desta via na presença de tensão induzida por movimento.
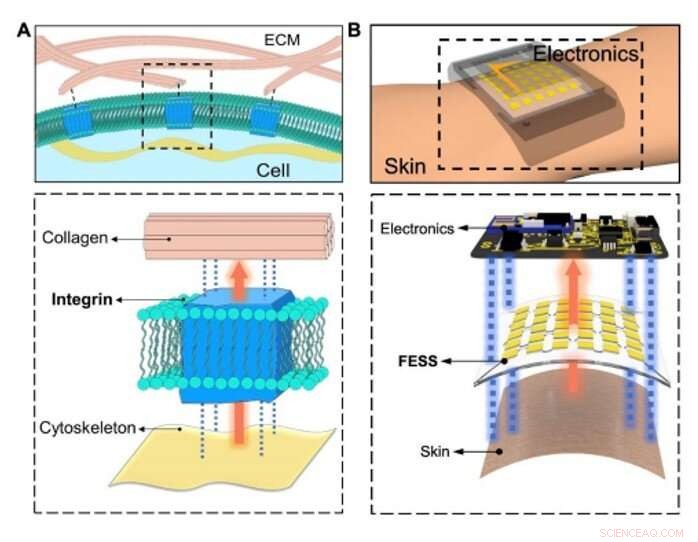
Detecção in situ bioinspirada e interconexão de sinal. (A) Ilustração conceitual da troca de informações fisiológicas entre matrizes intracelulares / extracelulares facilitada por moléculas adesivas celulares (integrina) por meio de detecção, interconexão de sinal fora do plano, e adesão frente e verso. (B) detecção in-situ, interconexão de sinal fora do plano, e adesão frente e verso habilitada pela FESS, como uma única entidade, colocado entre a pele e os eletrônicos. Crédito:Science Advances, doi:10.1126 / sciadv.aaz0007
Nesse trabalho, Zhao et al. desenvolveu o sistema de detecção eletroquímica autônomo (FESS) e, simultaneamente, o aderiu à pele e à eletrônica usando forças de adesão de dupla face sem conectores rígidos. O FESS amostrou e dirigiu biofluidos recuperados epidérmicamente para detecção eletroquímica, seguido de roteamento para leitura de eletrônicos por meio de um caminho isolado de tensão. Eles integraram o FESS dentro de um smartwatch personalizado para indução de suor, amostragem, detecção eletroquímica, processamento de sinal e exibição ou transmissão de dados. Os resultados mostraram transdução de sinal de alta fidelidade e contato mecânico robusto com a pele humana sem restringir o movimento do usuário. O sistema de detecção autônomo pode ser vinculado a futuros dispositivos eletrônicos vestíveis para gerar conjuntos de dados de alta fidelidade relacionados à saúde e ao bem-estar com base nas atividades diárias dos usuários.
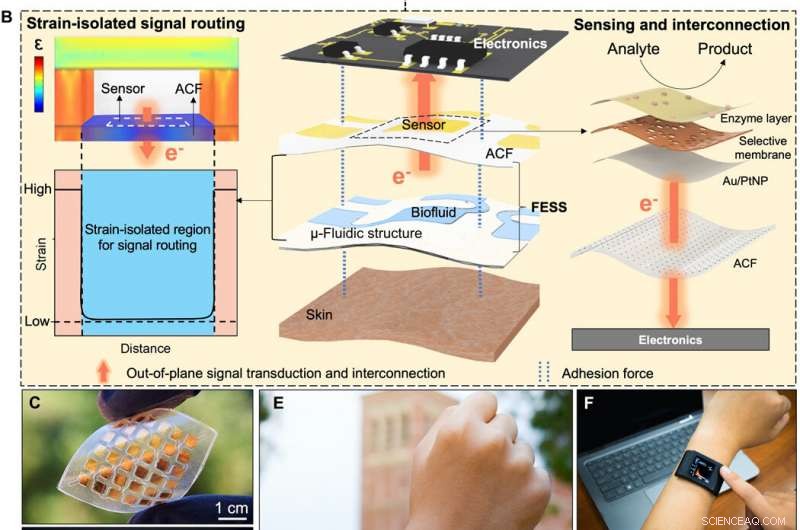
Para criar uma via biológica eficiente, Zhao et al. integrina selecionada - uma molécula adesiva celular que permitiu com eficiência a troca de informações fisiológicas entre matrizes intracelulares e extracelulares. O dispositivo FESS implementou funcionalidades semelhantes à integrina por meio de uma região isolada de cepa em uma estrutura microfluídica. Eles projetaram o FESS como um condutor vertical, adesivo de dupla face e sistema de filme fino bioanalítico microfluídico flexível composto de vários filmes empilhados verticalmente. Esses filmes incluíam um filme condutor anisotrópico adesivo (ACF), um filme de matriz de eletrodos de metal nobre, um filme bioquímico, um filme microfluídico e um filme adesivo para a pele. Eles colaram o sistema de filme fino completo na eletrônica de leitura sem conectores e com resistência de contato mínima para transformar potencialmente qualquer contato elétrico em um sensor químico ou biológico. A equipe desenvolveu uma prova de princípio, smartwatch autônomo com detecção de biomarcador com FESS para monitorar os perfis de metabólitos do suor de indivíduos em ambientes sedentários vs.

Simulação de deformação FESS e caracterização de interconexão de sinal isolada de deformação. (A) Ilustração da interconexão de sinal fora do plano do FESS versus interconexão de sinal convencional no plano. As implementações convencionais são restritas ao roteamento de sinal através de regiões altamente tensas, enquanto o FESS planejado permite o roteamento através de regiões de deformação quase zero. (B) Perfil de deformação simulada por COMSOL (ε) de um FESS representativo na presença de uma força de cisalhamento aplicada externamente, ilustrando a tensão quase zero na parte inferior do microcanal (isto é, interface substrato-biofluido). (C) Visualização ampliada correspondente do perfil de deformação para um "pixel". (D) Distribuição de tensão ao longo da linha tracejada em (C). (E) Caracterização elétrica de interconexão fora do plano de FESS realizada sob diferentes ângulos de flexão localizados (para uma matriz de eletrodos de 6 × 6 Au). (F) Resistências de interconexão do FESS-FPCB dobrado (RFESS + RFPCB), para diferentes ângulos de curvatura localizados (normalizados em relação ao RFPCB sem curvatura, RFPCB, 0). As barras de erro indicam o erro padrão das medições nos seis eletrodos em cada coluna. (G) Medições de resistência dos eletrodos FESS sob diferentes ângulos de flexão (n =36), em relação à resistência da almofada de contato FPCB (RFPCB, 0). (H a J) Testes de descascamento de 180 ° caracterizando a adesão de interconexão entre o PCB e FESS com diferentes estruturas de suporte:base microfluídica-ACF (H), canal microfluídico - ACF (I), e uma matriz de canal microfluídico representativa - ACF (J). (Foto:Peterson Nguyen, Universidade da Califórnia, Los Angeles.) Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aaz0007
Nesta configuração, a condutividade vertical do ACF facilitou as interconexões de sinal fora do plano para evitar efeitos de deformação induzidos por movimento corporal indesejados nas vias de sinal. A equipe caracterizou a propriedade de adesão mecânica do FESS para garantir que as forças de adesão entre o FESS e os componentes eletrônicos fossem maiores do que entre o FESS e a pele seca ou com suor ativo. A equipe testou a força necessária para descascar a camada ACF do FESS em uma placa de circuito impresso e os resultados mostraram uma forte interconexão baseada em FESS para a eletrônica, conforme adequado para aplicações no corpo.
Zhao et al. em seguida, testei a capacidade de transdução de sinal do FESS. Eles padronizaram eletrodos de metal nobre no ACF para alcançar a transdução de sinal bioquímico em elétrico, seguido pela deposição de filmes bioquímicos para analisar alvos biomoleculares de interesse. Eles testaram a atividade eletroquímica de ACF padronizado de metal para duas superfícies de eletrodo comumente usadas em ouro não modificado (Au) e Au modificado por nanopartículas de platina (Pt). Os métodos eletroanalíticos investigados no trabalho forneceram leituras de biomarcadores de amostra para resposta para obter informações em tempo real sobre as alterações na biocomposição do suor.

Testando a medição resistente das interconexões baseadas em ACF após a deformação mecânica. Crédito:Science Advances, doi:10.1126 / sciadv.aaz0007
Nos próximos experimentos, a equipe de pesquisa mostrou a capacidade do FESS de monitorar biomarcadores durante as atividades diárias do usuário. Para conseguir isso, eles integraram o FESS em um smartwatch desenvolvido sob medida como um modelo de dispositivo IOT contendo um circuito analógico / digital, Transceptor Bluetooth e uma tela de cristal líquido (LCD) para funcionalidades de nível de sistema, incluindo processamento de sinal e comando do usuário, display e comunicação de dados sem fio. O smartwatch baseado em FESS teve desempenho semelhante a um potenciostato. Os cientistas aderiram o smartwatch completo à pele sem invólucros externos ou acessórios para detecção de biomarcador sem fio como uma unidade independente. A tela LCD exibia leituras em tempo real e perfil temporal das medições do biomarcador, enquanto o receptor Bluetooth retransmitia as leituras para um aplicativo móvel desenvolvido sob medida para fazer o upload dos dados para um servidor em nuvem para análise posterior.
A equipe aderiu o smartwatch baseado em FESS no antebraço de um sujeito para exibir sua função como um sistema vestível para monitorar biomarcadores. O assunto pode controlar sem fio o dispositivo para obter em tempo real, medições de biomarcadores baseados em suor em relação à rotina diária do usuário. O usuário monitorou seus níveis de glicose no suor antes ou depois de consumir uma variedade de refeições e a leitura do smartwatch indicou níveis elevados de glicose no suor após a ingestão de alimentos, em alinhamento com as tendências anteriores. O smartwatch também forneceu informações ao usuário sobre as leituras de lactato no suor durante a corrida em um campo, os resultados foram consistentes, apesar do envolvimento de movimentos corporais baseados em alta frequência e alta aceleração.
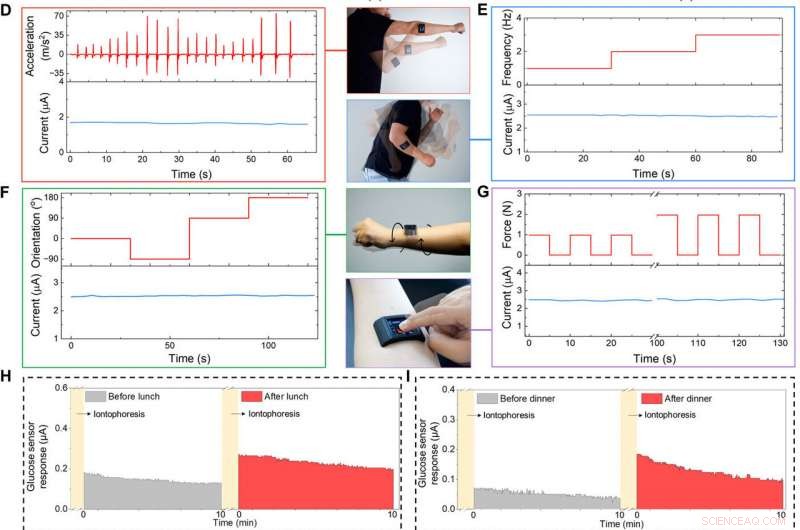
Smartwatch integrado ao FESS desenvolvido sob medida para aplicação no corpo. (A) Ilustração do smartwatch habilitado para FESS (contendo FESS, Ecrã LCD, PCB, e unidades de bateria alojadas em uma caixa impressa em 3D). (B e C) Caracterização ex situ da resposta do sistema de detecção de glicose FESS-PCB após vibração vortical (eletrodo FESS:6 mm2, altura do canal microfluídico:170 μm, e volume:4 μl). Os perfis de aceleração vibracional são apresentados na metade superior, e as respostas do sensor são capturadas na metade inferior quando testado em PBS (B) e glicose 100 μM em PBS (C). (D a G) Caracterização de fidelidade de sinal corporal de um sistema de detecção de lactato FESS-PCB com um sujeito realizando shadow boxing (D), braço balançando (E), torção do pulso (F), e dispositivo pressionando (G). A aceleração, frequência, orientação, e os perfis de força são apresentados na metade superior, e as respostas do sensor são capturadas na metade inferior. (H a J) Monitorar os perfis de metabólitos dos sujeitos por meio de vários eventos diários e em diferentes configurações. A glicose no suor induzida iontoforeticamente foi medida antes e depois do almoço (H) e do jantar (I). (J) Medições de lactato no suor durante o exercício (um perfil representativo de aceleração induzida por movimento é mostrado à direita). (Foto:Peterson Nguyen, Kaili Chiu, e Yichao Zhao, Universidade da Califórnia, Los Angeles.) Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aaz0007
Desta maneira, Yichao Zhao e seus colegas examinaram a via de entrega de informações do biomarcador e reconheceram regiões tensas quase nulas dentro de um módulo de detecção microfluídica para projetar um caminho isolado de cepa para preservar a fidelidade dos dados do biomarcador. O sistema de filme fino que formou a entidade FESS autônoma foi bioinspirado por funcionalidades semelhantes à integrina para transdução de sinal e interconexão de sinal via adesão de dupla face. O FESS conectou com eficiência a pele e os componentes eletrônicos de leitura para coletar informações de biomarcadores. A equipe acoplou o sistema FESS perfeitamente a um smartwatch desenvolvido sob medida como um biossensor vestível para monitorar leituras de biomarcadores em tempo real ao longo da rotina diária do usuário. Para comercializar o protótipo desenvolvido neste trabalho, Zhao et al. propor futuros ensaios clínicos para mapear leituras de biomarcadores baseados em suor e obter informações sobre o estado fisiológico dos usuários. As vantagens deste trabalho, incluindo sua facilidade de integração com aparelhos eletrônicos vestíveis e leituras de alta fidelidade, podem ser empregados para realizar investigações clínicas em larga escala.
© 2020 Science X Network