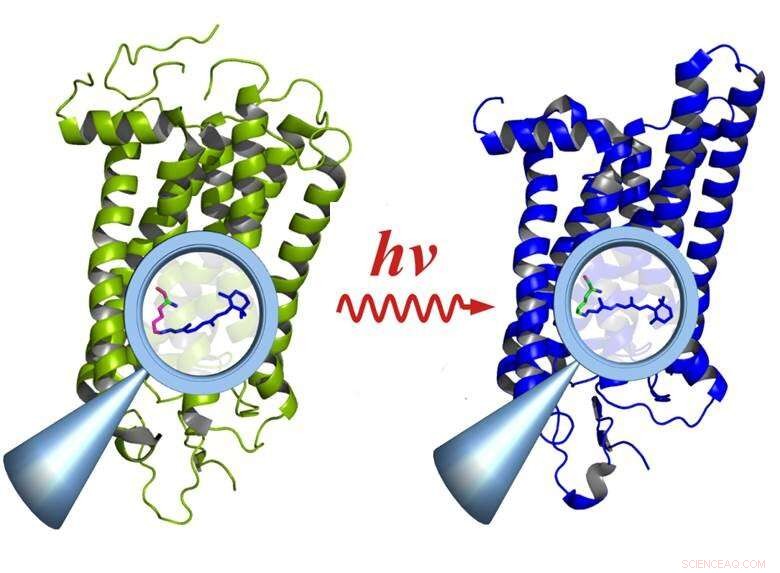
Rodopsina antes (esquerda) e depois da ativação pela luz (direita):A ativação causa mudanças nos grupos funcionais dentro da molécula (lupa), que afetam a molécula inteira. Crédito:E. Ritter / HZB
A espectroscopia infravermelha resolvida no tempo na faixa de submilissegundos é um método importante para estudar a relação entre função e estrutura em moléculas biológicas. Contudo, o método só funciona se a reação puder ser repetida milhares de vezes. Este não é o caso de um grande número de processos biológicos, no entanto, porque muitas vezes se baseiam em reações muito rápidas e irreversíveis, por exemplo, em visão. Os quanta de luz individuais que entram nos bastonetes da retina ativam as moléculas de proteína de rodopsina, que então decaem após cumprir sua função de fototransdução.
Agora, uma equipe chefiada pelo Dr. Ulrich Schade (HZB) e Dr. Eglof Ritter (Humboldt-Universität zu Berlin) na linha de luz IRIS de BESSY II desenvolveu um novo instrumento que pode detectar esses tipos de reações muito rápidas e / ou irreversíveis com uma única medição. A resolução de tempo é de alguns microssegundos. O instrumento, um espectrômetro Féry, usa um detector altamente sensível conhecido como conjunto de detectores de plano focal e ótica especial para otimizar o uso da radiação infravermelha brilhante da fonte síncrotron BESSY II. A equipe usou este dispositivo para observar a ativação da rodopsina em condições quase in vivo pela primeira vez.
"Usamos a rodopsina porque ela se decompõe irreversivelmente após ser excitada pela luz e, portanto, é um verdadeiro teste ácido para o sistema, "explica Ritter, primeiro autor do estudo. A rodopsina é uma molécula de proteína que atua como um receptor e é o pigmento da visão encontrado nos bastonetes da retina do olho. Até mesmo um único fóton pode ativar a rodopsina - permitindo que o olho perceba níveis extremamente baixos de luz. Além disso, rodopsina é o elemento comum em uma classe de receptores com centenas de membros responsáveis pelo olfato, gosto, sensação de pressão, recepção hormonal, etc. —todos funcionam de maneira semelhante.
A equipe também estudou outra proteína excitante na faixa do infravermelho pela primeira vez:a actinorodopsina. Essa molécula é capaz de converter a energia da luz em corrente elétrica - uma propriedade que algumas bactérias usam para gerar energia eletroquímica para seu metabolismo.
"O novo método nos permite investigar os mecanismos de reação molecular de todos os processos irreversíveis (ou processos cíclicos lentos), como aqueles na área de conversão e armazenamento de energia, por exemplo, "enfatizou Schade, que chefia a equipe IRIS.