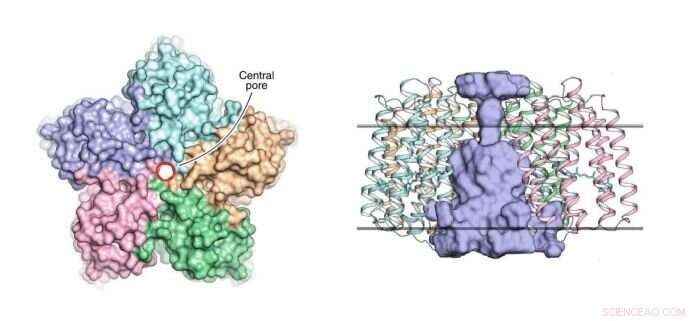
Esquerda:uma visão do pentâmero OLPVRII do lado citoplasmático. O poro central é contornado por um círculo vermelho. À direita:uma vista lateral do pentâmero. O poro central é de cor azul claro. Os limites do núcleo da membrana hidrofóbica / hidrofílica são mostrados como linhas horizontais sólidas. Crédito:Dmitry Bratanov et al./Nature Communications
A estrutura de uma rodopsina II de Phycodnavirus do lago orgânico (OLPVRII), que é uma proteína única encontrada no genoma de vírus gigantes, foi determinado graças ao trabalho de graduados e Ph.D. do MIPT alunos. O artigo foi publicado em Nature Communications .
O estudo é o resultado de uma colaboração que incluiu muitos ex-alunos do MIPT. Dmitry Bratanov estava entre eles. Dmitry, que atualmente trabalha no Instituto de Sistemas Complexos (ICS-6) no Centro de Pesquisa Juelich, Alemanha, diz que embora as rodopsinas virais tenham sido descobertas pela primeira vez nos chamados vírus gigantes há vários anos, sua estrutura, função, e o papel biológico permaneceram obscuros até agora.
Um vírus gigante é um vírus muito grande, o tamanho de uma bactéria típica. É tão grande que é visível ao microscópio óptico. Os vírus gigantes infectam algas verdes, que produzem oxigênio e ajudam a manter o equilíbrio ecológico natural do oceano mundial. Portanto, vírus gigantes são de considerável interesse de pesquisa de uma perspectiva ambiental.
"Nesse trabalho, deciframos a estrutura de alta resolução do OLPVRII, caracterizou funcionalmente a proteína, e mostrou que forma pentâmeros não apenas em cristais, mas também em membranas lipídicas, "explica Dmitry." Não foi uma tarefa fácil. Numerosos experimentos tiveram que ser realizados, para alguns deles usamos técnicas e equipamentos sofisticados. O que conseguimos é o resultado do trabalho árduo e meticuloso do grupo internacional de cientistas. "
Esta organização pentamérica já foi observada em algumas outras rodopsinas, tal como, por exemplo, na bomba de sódio movida a luz KR2. Contudo, o que torna a estrutura OLPVRII peculiar é que ela possui um poro incomum no centro (veja a figura 1). Sua função permanece desconhecida.
"Achamos que talvez o poro atue como um canal iônico, muito provavelmente para íons de cloreto, "diz Kirill Kovalev, um co-autor do artigo e Ph.D. aluno do MIPT.
Canais de íons são proteínas que criam uma via passiva para que os íons fluam através da membrana celular. Esses canais geralmente são fechados no escuro, o que significa que os íons não podem entrar ou sair da célula. No caso de canais sensíveis à luz, eles abrem em resposta à absorção de luz, o que permite que os íons fluam para baixo no gradiente de concentração. Em outras palavras, os íons se movem na direção que igualaria as concentrações de íons dentro e fora da célula.
Um exemplo típico de canal sensível à luz é o canal rodopsina 2. Foi encontrado na alga verde Chlamydomonas reinhardtii e é amplamente utilizado como ferramenta optogenética. Quanto a OLPVRII, os pesquisadores acham que este pode ser o primeiro canal iônico controlado por luz pentamérica já descoberto, como sugerido pela estrutura determinada e simulações moleculares.
"Contudo, a atividade do canal de OLPVRII ainda não foi demonstrada, "observa Kirill Kovalev." Continuaremos nossa pesquisa e definitivamente descobriremos por que essa rodopsina incomum foi criada pela natureza. Talvez ajude o hospedeiro a continuar a realizar suas funções de sustentação da vida quando uma célula é infectada por um vírus, ou talvez seja um sensor. "
Dito isto, estudar a estrutura da rodopsina viral esclareceu como ela funciona. Foi demonstrado que OLPVRII, como a maioria das outras rodopsinas, atua como uma bomba de prótons. No entanto, é improvável que esta seja sua função principal, dizem os pesquisadores. Seu principal objetivo ainda não foi investigado e comprovado.
"Se provarmos que esta rodopsina viral é na verdade um canal iônico, pode se tornar uma ótima ferramenta em aplicações optogenéticas e biomédicas, "diz o co-autor do artigo Valentin Gordeliy, que lidera grupos de pesquisa no Instituto de Biologia Estrutural de Grenoble e no Centro de Pesquisa Juelich. Valentin também é coordenador de pesquisa do Centro de Pesquisa para Mecanismos Moleculares do Envelhecimento e Doenças Relacionadas à Idade do MIPT.
Os pesquisadores dizem que a nova ferramenta terá desempenho superior a todas as suas contrapartes graças às vantagens de sua estrutura pentamérica:a facilidade com que você pode manipular geneticamente as propriedades da proteína e talvez as altas correntes que circulam pelo poro central.
Para ter o direito prioritário de utilizar sua invenção, os autores do artigo apresentaram um pedido de patente para o uso da rodopsina viral OLPVRII no campo da optogenética.
A optogenética é um ramo da biofísica que usa a luz para controlar as células de um organismo vivo. Como já foi demonstrado, a optogenética pode ser aplicada para restaurar a visão e a perda auditiva, ajudam a controlar o movimento em pacientes neurológicos, e tratar aqueles com doença de Parkinson e Alzheimer.
De acordo com Valentin Gordeliy, O MIPT possui todo o equipamento necessário para realizar um estudo detalhado das funções da rodopsina viral. O grupo continuará sua pesquisa em OLPVRII, que será de grande importância para a biologia, ciência evolucionária, optogenética, e ecologia.