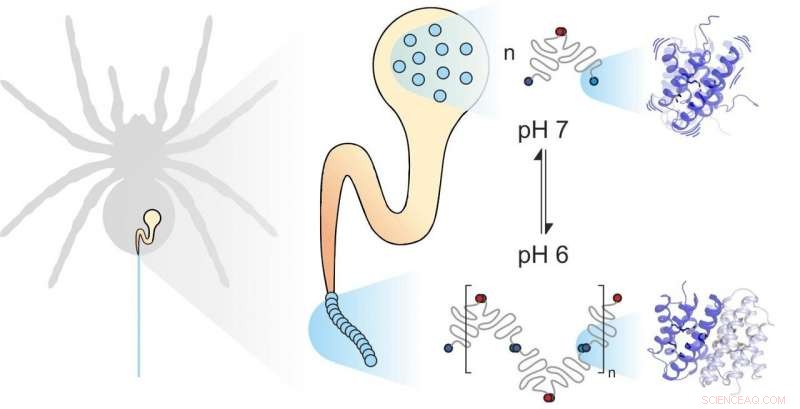
A seda da aranha é composta de proteínas individuais. Fatores mecânicos e químicos influenciam como eles se montam. A dinâmica das subunidades desempenha um papel importante. Crédito:Benedikt Goretzki, Ute Hellmich
A seda da aranha consiste em proteínas formadoras de fibras, armazenado pela aranha em uma glândula especializada. Quando a aranha precisa de seda, por exemplo, para construir uma web, ele expulsa as proteínas da seda por meio de um longo duto no qual são expostas a influências mecânicas e químicas específicas e montadas para formar a seda. Proteínas de seda de aranha, como todas as proteínas, consistem em 20 blocos de construção elementares conhecidos como aminoácidos. O número e a sequência desses aminoácidos determinam as propriedades de proteínas individuais. Por exemplo, se aminoácidos hidrofóbicos, como a leucina, estão localizados no centro de uma proteína, o resultado é uma estabilidade estrutural considerável. Portanto, você pode esperar que a seda da aranha extremamente forte contenha uma grande quantidade de leucina. Para sua surpresa, Contudo, cientistas das universidades de Mainz e Würzburg descobriram que outro bloco de construção, metionina, é altamente abundante em algumas proteínas da seda de aranha.
As cadeias laterais de metionina são conhecidas por serem altamente flexíveis. "Foi essa abundância de metionina na proteína da seda da aranha que nos fez dar uma olhada em sua dinâmica, "disse o professor Ute Hellmich da Johannes Gutenberg University Mainz (JGU)." Nossa colaboração com a equipe do Dr. Hannes Neuweiler na Julius-Maximilians-Universität Würzburg (JMU) nos deu acesso a ferramentas de pesquisa biofísica de última geração. "
O grupo de Würzburg substituiu sistematicamente o aminoácido metionina nas proteínas da seda da aranha por leucina e comparou o dobramento, estabilidade, e dinâmica das variantes de proteínas resultantes com a ajuda de espectroscopia de correlação de fluorescência de transferência de elétrons foto-induzida (PET-FCS). Dr. Hannes Neuweiler foi fundamental no desenvolvimento desta técnica, e seu laboratório é líder mundial em empregá-lo para investigar sistemas biológicos. A equipe do professor Ute Hellmich então investigou a estrutura e a dinâmica das duas variantes da proteína usando espectroscopia de ressonância magnética nuclear de alta resolução (NMR). "Realizamos nossas medições de NMR no Centro de Ressonância Magnética Biomolecular da Goethe University Frankfurt - outro exemplo do potencial gerado por nossa cooperação na rede da Universidade Rhine-Main, "enfatizou Hellmich.
Os blocos de construção de metionina nas proteínas da seda da aranha fornecem flexibilidade
A combinação de PET-FCS e espectroscopia de NMR levou os dois grupos de pesquisa à conclusão inesperada de que a metionina na proteína da seda da aranha aumenta a flexibilidade da estrutura da proteína, e que essa flexibilidade é precisamente o que permite que as proteínas individuais da seda da aranha interajam intimamente. "Descobrimos que substituir a metionina por leucina não tem efeito sobre a estrutura da proteína da seda da aranha. Na verdade, ambas as proteínas parecem exatamente iguais. Ao mesmo tempo, Contudo, a proteína natural contendo metionina liga-se muito mais fortemente a outras proteínas da seda da aranha. A proteína contendo leucina que sintetizamos em laboratório perde amplamente essa capacidade de formar tais ligações estáveis, "apontou Benedikt Goretzki, um candidato a doutorado na equipe de Hellmich e um dos dois principais autores do estudo publicado em Nature Communications . "Ficamos realmente maravilhados, pois isso mostra que não é apenas a forma de uma proteína que determina como ela funciona, mas também, em um grau considerável, sua flexibilidade. "
"A metionina não só torna a proteína mais dinâmica, também melhora sua funcionalidade. Com efeito, permite que duas proteínas se interliguem especificamente uma com a outra, que de outra forma seria impossível, mesmo se eles tivessem a mesma estrutura, "esclareceu Julia Heiby, candidato a doutorado no grupo de Neuweiler e o outro autor principal do estudo.
"A forma segue a função" é uma regra prática na biologia estrutural. Em outras palavras, o que uma proteína geralmente faz pode ser deduzido de sua estrutura tridimensional. "É impressionante como a natureza também pode influenciar a função das proteínas, adaptando com precisão sua dinâmica, "acrescentou o bioquímico de Mainz, Professor Ute Hellmich.
Com base nessas descobertas, agora pode ser possível modificar seletivamente as propriedades das proteínas da seda da aranha, por exemplo, para sintetizar novos biomateriais altamente estáveis. Além disso, os dois grupos também esperam fornecer insights gerais sobre a relevância da dinâmica das proteínas em relação às suas funções biológicas. "A dinâmica das proteínas é importante em todos os aspectos da vida, "concluiu Hellmich." Isso é verdade tanto para aranhas quanto para humanos. "