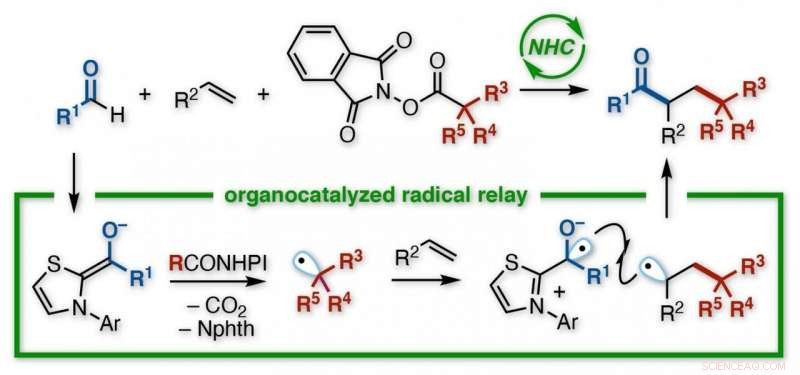
Uma equipe de pesquisa japonesa na Universidade de Kanazawa desenvolveu uma reação para a criação de cetonas funcionalizadas. Usando um organocatalisador de carbeno N-heterocíclico (NHC), sem necessidade de metais ou irradiação leve, um acil e um grupo alquil são adicionados através da ligação dupla de um alqueno. O NHC dá controle regiosseletivo sobre um processo de relé envolvendo a transferência de elétrons seguida pela adição sucessiva de dois radicais ao alceno. Os diversos produtos são blocos de construção úteis para outras sínteses. Crédito:Kanazawa University
Químicos orgânicos são arquitetos moleculares, projetar estruturas sofisticadas. À medida que as moléculas usadas na ciência e na medicina se tornam cada vez mais complexas, novas ferramentas são necessárias para juntar os blocos de construção. Agora, uma equipe japonesa da Universidade de Kanazawa desenvolveu uma reação que liga três componentes ao mesmo tempo, usando a química dos radicais livres.
Duplas ligações carbono-carbono, conhecidos como alcenos, são mais reativos do que ligações simples. Isso os torna úteis para conectar grupos diferentes:se a ligação dupla for quebrada, duas novas moléculas podem ser adicionadas em cada extremidade, ligados entre si pelo ex-alceno, agora com ligação única.
A equipe de Kanazawa procurou maneiras de alcançar essa transformação usando aldeídos, que contém uma ligação dupla entre oxigênio e carbono, como uma das duas moléculas enxertadas em um alceno. Conforme relatado no Jornal da American Chemical Society , o objetivo era criar cetonas altamente funcionalizadas, uma importante família de compostos em síntese orgânica.
O método escolhido foi uma reação conhecida, evocativamente, como um relé radical. Contendo um elétron desemparelhado, e, portanto, um orbital meio vazio, radicais (ou radicais livres) tendem a ser vorazmente reativos. Tão reativo, na verdade, que eles não podem ser armazenados, mas deve ser gerado in-situ, arrancando um elétron de algum lugar durante uma reação, desencadeando uma cascata de quebra de vínculo e criação.
Os químicos podem fazer radicais de várias maneiras, mas a equipe de Kanazawa queria testar um oraganocatalisador, denominado carbeno N-heterocíclico (NHC). Com um aldeído como reagente, e um éster redox funcionalizado como o outro, o NHC desencadeou sua transformação em radicais. Estudos anteriores sugeriram que ambos os radicais reagiriam mais rápido com um alceno do que um com o outro.
"O desafio com os radicais é que, sendo tão instável, eles costumam reagir com eles mesmos, "diz o co-autor do estudo, Kazunori Nagao." Então você recebe de volta seus materiais iniciais, ou um subproduto, em vez do alvo. Nós minimizamos isso aqui. Na verdade, a reação prosseguiu como um relé - primeiro o radical alquil adicionado a um carbono do alqueno, e então o radical acila adicionado ao outro. "
O composto resultante tinha uma cetona e um grupo derivado de éster ligado a dois carbonos adjacentes, em um assim chamado arranjo vicinal. Embora a reação direta entre os diferentes radicais também tenha ocorrido - dando um produto de dois componentes indesejado, em vez do alvo de três componentes com ponte de alceno - era menor. Além disso, uma ampla gama de materiais de partida eram compatíveis com o processo.
"Dois pontos cruciais devem ser mencionados, "diz Hirohisa Ohmiya, autor correspondente do estudo. "Primeiro, ao contrário de algumas reações, o nosso é livre de catalisadores metálicos e não precisa de uma fonte de luz para produzir radicais, tornando-o verde e versátil. Segundo, o NHC controla precisamente o relé, para que possamos ser seletivos nas posições dos grupos funcionais. Agora estamos trabalhando em uma versão assimétrica para produtos quirais. "