
Crédito CC0:domínio público
Hidrogênio, o elemento mais abundante do universo, embala um soco poderoso. E porque não contém carbono, ele produz apenas água quando usado como combustível. Mas na Terra, hidrogênio na maioria das vezes existe em combinação com outros elementos, o que significa que precisa ser extraído.
Para aproveitar a energia limpa do hidrogênio para aplicações de energia e outros usos, pesquisadores estão procurando maneiras acessíveis de produzir e armazenar hidrogênio.
Uma nova pesquisa do Pacific Northwest National Laboratory (PNNL) mostra que uma combinação de minerais humildes ofusca outros materiais de metais preciosos no que diz respeito à produção de hidrogênio. Com colaboradores da Oregon State University (OSU), os pesquisadores testaram um catalisador de fosfeto de molibdênio (MoP) com águas residuais em um pequeno reator chamado célula de eletrólise microbiana (MEC). Os resultados do teste mostraram que o MoP funcionou melhor do que a platina, um metal precioso e caro, normalmente usado por seu alto desempenho catalítico. O catalisador MoP também produziu hidrogênio cinco vezes mais rápido do que outros catalisadores não platinados relatados em estudos relacionados.
Mas o verdadeiro chute? Seu catalisador também funcionou bem com água do mar.
"Se você pode produzir hidrogênio a partir da água do mar, o pool de recursos é praticamente ilimitado, "disse Yuyan Shao, um cientista de materiais do PNNL que liderou a pesquisa do catalisador.
Como a água do mar, o material do catalisador MoP está amplamente disponível, e portanto, barato. O catalisador também trabalhou com águas residuais, outro recurso onipresente.
Detalhes do estudo da equipe aparecem no jornal Catálise ACS . As descobertas resultam de um projeto de três anos financiado pelo Escritório de Tecnologias de Células Combustíveis do Departamento de Energia.
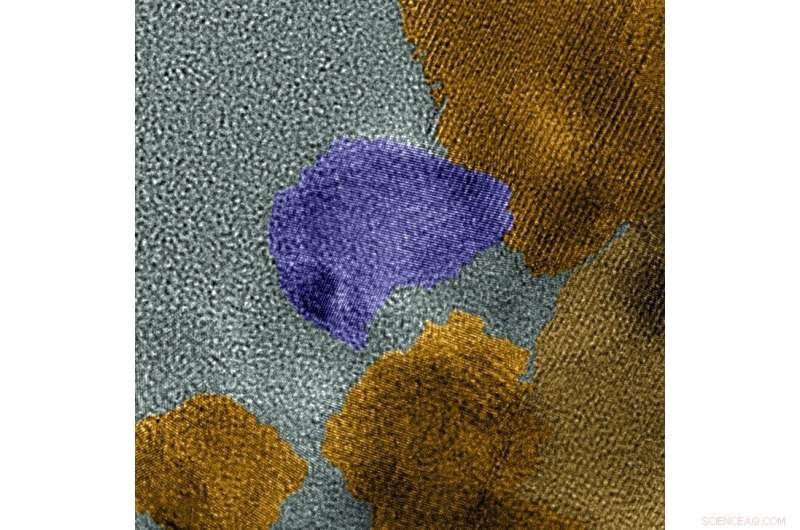
Esta imagem colorida do microscópio TEM de alta resolução mostra as duas fases do catalisador, MoP em roxo, MoP2 em amarelo. Crédito:Laboratório de Ciências Moleculares Ambientais
Uma alternativa melhor
Um dos métodos mais comuns de produção de hidrogênio é um processo chamado eletrólise. Este processo combina eletricidade com vários produtos químicos, chamados eletrólitos, e um material catalisador sólido. A reação resultante produz hidrogênio, mas todo o processo usa muita energia e recursos caros como a platina.
A fermentação usando fontes renováveis ou fluxos de resíduos é uma promessa para a produção de hidrogênio a preços acessíveis. Mas o processo de fermentação funciona lentamente, os rendimentos são baixos, e o fluxo de produto requer uma limpeza cara devido a outros subprodutos da fermentação. Em MECs, uma corrente elétrica é acoplada com bactérias para decompor orgânicos e produzir hidrogênio. Infelizmente, as células também usam platina cara para a superfície de reação, e se catalisadores não-platina forem usados, os rendimentos de hidrogênio permanecem baixos.
Na OSU, os pesquisadores desenvolveram um projeto MEC híbrido no qual a fermentação e a eletrólise ocorrem em um único recipiente, em oposição a etapas separadas, e os subprodutos são consumidos diretamente no processo. Este design integrado aumenta a produtividade e reduz os custos do equipamento. Mas com o alto custo da platina, a equipe precisava de um catalisador que pudesse reduzir os custos de produção para cerca de dois dólares por quilo de hidrogênio.
Surpresa de segunda fase
Com base em descobertas anteriores com o catalisador MoP, Os pesquisadores do PNNL investigaram o catalisador para uso em MECs. A equipe de pesquisa começou com a combinação MoP por causa de sua afinidade para ativação, ou separando, moléculas de água. O catalisador também é ajustável - a quantidade de cada mineral pode ser ajustada. De acordo com a hipótese da equipe, esse ajuste otimizaria a quantidade de hidrogênio produzida em uma única reação.
Eles estavam parcialmente certos.
Sob um microscópio poderoso, eles descobriram que o catalisador é montado em uma mistura de duas fases distintas de cristal - MoP e MoP 2 . A estrutura atômica para cada fase era diferente, levando a reações diferentes. Enquanto o MoP2 liberou átomos de hidrogênio das moléculas de água, O MoP converteu os átomos de hidrogênio em moléculas de gás hidrogênio. Os dois sites ativos impulsionaram a reação geral.
“Não esperávamos a formação simultânea das duas fases do cristal, "disse Shao." As duas fases funcionam muito melhor do que a fase única.
Os pesquisadores realizaram seus experimentos em condições de pH neutro em ambas as células híbridas em OSU usando água residual e em outro reator em PNNL usando água do mar, com resultados consistentes. Shao disse que essas descobertas dão aos pesquisadores a confiança de que o método é confiável, elimina platina e outros subprodutos, e é uma grande promessa para o avanço das tecnologias de hidrogênio e células de combustível.