
Os pesquisadores da Rice University desenvolveram um complexo à base de rutênio capaz de rastrear a formação de agregados de peptídeo beta amilóide solúvel, implicados no início da doença de Alzheimer. Crédito:Jeff Fitlow / Rice University
Os pesquisadores da Rice University descobriram uma maneira de rastrear a formação de agregados de peptídeos beta amilóides solúveis, implicados no início da doença de Alzheimer.
O laboratório Rice de Angel Martí relatou o desenvolvimento de um complexo fluorescente à base de rutênio que se liga ao solúvel, peptídeos beta amilóides oligoméricos. À medida que os peptídeos se unem para formar as grandes biomoléculas chamadas oligômeros, o aditivo fluorescente os liga e os rotula.
Isso permitirá que os pesquisadores acompanhem facilmente o progresso e os movimentos dos agregados à medida que crescem ao longo do tempo. Os detalhes do trabalho aparecem no Jornal da American Chemical Society .
Há muito se suspeita que as placas amilóides sejam a causa raiz do Alzheimer, mas estudos recentes sugerem que os oligômeros - moléculas flutuantes com unidades peptídicas repetidas - causam muito mais danos.
"Há uma visão na área de que os oligômeros solúveis são a principal causa da degeneração neuronal, porque esses oligômeros são tóxicos para os neurônios, "disse Martí, um professor associado de química, da bioengenharia e da ciência dos materiais e nanoengenharia.
"Esses oligômeros estão definitivamente associados à patologia de Alzheimer, portanto, houve necessidade de ferramentas para nos ajudar a estudá-los. "

Bo Jiang, estudante de graduação da Rice University, mostra um frasco fluorescente de agregados de peptídeo beta amilóide solúvel, implicados no aparecimento da doença de Alzheimer. Os peptídeos são marcados e rastreados com um complexo de rutênio desenvolvido na Rice que pode monitorá-los em experimentos de laboratório à medida que crescem ao longo do tempo. Crédito:Jeff Fitlow / Rice University
Ele disse que os oligômeros são "virtualmente invisíveis" para os corantes Tioflavina T comumente usados para marcar fibrilas amilóides em estudos de laboratório. Os complexos de rutênio resolvem esse problema.
Os complexos tiram vantagem da anisotropia de fluorescência, em que a resposta fluorescente é polarizada, brilhando mais forte em algumas direções do que em outras. “É uma técnica muito antiga relacionada à rotação de moléculas, "Martí disse." Quando a molécula está em solução, ele se move e gira constantemente. Quando é muito pequeno, ele gira muito rápido e a anisotropia é quase zero.
"Mas quando a mesma sonda se liga a uma grande macromolécula, gira mais devagar, "disse ele." É assim que sabemos que temos oligômeros, e então podemos rastrear seu crescimento e propagação. "
Os testes de laboratório mostraram oligômeros se formando em solução em diferentes temperaturas ao longo de horas. Martí observou que as soluções frias retardam o processo, mas na temperatura corporal, os oligômeros se formam "muito rápido e em grandes quantidades. A velocidade com que se formam em temperaturas fisiológicas é notável."
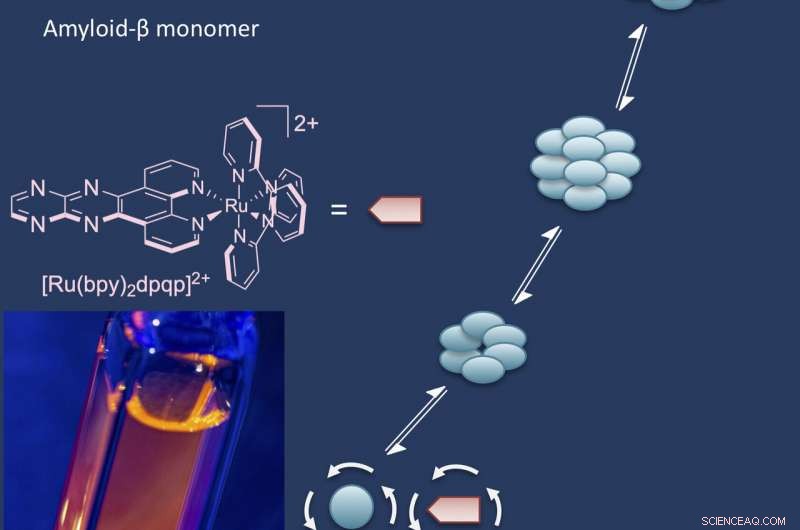
Uma etiqueta à base de rutênio desenvolvida na Rice University aproveita a anisotropia fluorescente para medir a rotação dos oligômeros beta amilóides à medida que crescem em solução. Pequenos agregados giram rapidamente, enquanto grandes oligômeros giram lentamente, uma característica que permite aos pesquisadores observar enquanto eles crescem. Os oligômeros de beta amilóide são tóxicos para os neurônios e implicados como uma possível causa da doença de Alzheimer. Crédito:Angel Martí Group / Rice University
O laboratório Rice também usou suas sondas para ver como as células do neuroblastoma foram afetadas em tempo real quando injetadas com peptídeos beta amilóides. Eles revelaram que apenas 60% das células injetadas com oligômeros permaneceram viáveis, enquanto aqueles tratados com fibrilas amilóides e monômeros tiveram maior viabilidade, cerca de 80%, sugerindo que os oligômeros são realmente tóxicos, Disse Martí.
Por enquanto, ele disse, as sondas de rutênio devem ser usadas apenas em laboratório. "Será difícil usar isso no cérebro porque há muita dispersão de luz, "Martí disse." Eles são feitos para aproveitar a luz polarizada, e a dispersão iria amortecer isso. "
"Mas como uma ferramenta de laboratório, eles permitirão que pesquisadores de todo o mundo testem os efeitos de outras moléculas na taxa de formação de oligômeros, e isso é um grande negócio, "ele disse." Eles podem ver rapidamente se uma droga atrasa ou interrompe a formação de oligômeros. "