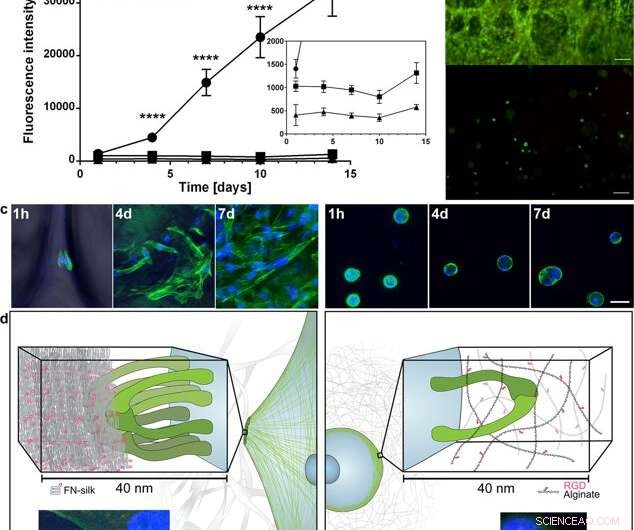
Espalhamento e expansão de células dentro da seda FN em comparação com quando encapsulado em um hidrogel acoplado a RGD. (a) Gráfico representativo (média e desvio padrão) do ensaio de viabilidade Alamar Blue mostrando a atividade metabólica de fibroblastos (HDF) dentro da espuma de seda FN (círculo), um hidrogel de alginato de muito baixa viscosidade (VLVG) acoplado com RGD (quadrado), e um hidrogel de alginato de média viscosidade (MVG) acoplado a RGD (triângulo) durante duas semanas de cultivo. Inserir mostra um zoom em vista das intensidades mais baixas. Estatísticas (teste t de alunos em cada ponto de tempo):**** indica p <0,0001 (n =12) (b) Coloração viva (verde) e morta (vermelha) representativa de células-tronco mesenquimais humanas (HMSC) em FN- espuma de seda (superior) e alginato acoplado a RGD VLVG (inferior) no dia 14. Barras de escala =100 µm. (c) Varreduras confocais de HMSCs integrados em espuma de seda FN (painel esquerdo), e hidrogel de alginato acoplado a RGD MVG (painel direito) após 1 h, 4 dias e 7 dias. Os filamentos de actina são visualizados por coloração com faloidina (verde) e os núcleos das células são corados com DAPI (azul). Barras de escala =20 µm. (d) Descrição esquemática da hipótese para a razão por trás da diferença observada nas interações entre as células e a seda (à esquerda) versus os hidrogéis de alginato acoplado a RGD (à direita). Vários pares de integrinas (verdes) podem aderir e se juntar às microfibras de seda, formando aderências focais na borda dos filamentos de actina, permitindo que as células se espalhem e proliferem. No hidrogel de alginato, um único par de integrina (verde) pode se ligar ao motivo RGD acoplado, mas as finas cadeias de alginato restringem a reunião subsequente em aderências focais. As inserções mostram exemplos de uma célula (fibroblasto) após 3 h em espuma de seda FN (esquerda) e um hidrogel de alginato de baixa viscosidade (VLVG) acoplado a RGD (direita). Os filamentos de actina são visualizados por coloração com faloidina (verde), e aderências focais podem ser vistas onde isso é co-localizado com a coloração para vinculina (vermelho, marcado com uma seta). Os núcleos das células são corados com DAPI (azul). Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-42541-y
Os tecidos biológicos são construídos quando as células se ancoram em locais específicos em uma rede de microfibra 3-D em uma matriz extracelular (ECM). Os cientistas estão ansiosos para recriar tecidos biológicos em laboratório usando engenharia de tecidos bioinspirada e engenharia genética, para formar motivos ECM funcionais fundidos com proteínas de seda recombinantes. Sob condições fisiológicas adequadas, proteínas da seda modificadas pela bioengenharia e fibronectina-seda (FN-seda) podem se automontar em redes de microfibras que imitam ECM nativo.
Em um estudo recente, Ulrika Johansson, Mona Widhe e colegas de trabalho nos departamentos interdisciplinares de Biotecnologia, Química de biomateriais, e a Immunology, na Suécia, desenvolveu um método para incluir células de mamíferos em uma solução de seda antes de montar a seda em construções, para formar microfibras semelhantes a tecido, integradas em células uniformes. Os construtos de arcabouço 3-D resultantes mostraram proliferação celular (crescimento) melhorada e disseminação celular homogênea em comparação com células encapsuladas em hidrogel. Os resultados do estudo estão agora publicados em Relatórios Científicos .
Os cientistas confirmaram a fixação de células em construções de fibronectina-seda (FN-Silk) no trabalho, observando a actina filamentosa e definindo pontos de adesão focais do anexo, células alongadas. Eles mantiveram a viabilidade celular por 90 dias nas superfícies de célula-FN / seda e mostraram escalabilidade do método para culturas de células 3-D de tamanho macro. Os feixes de microfibra de seda com células encapsuladas mantiveram a força biomecânica e a extensibilidade muito semelhante às paredes arteriais humanas.
O protocolo desenvolvido por Johansson e Widhe et al. também permitiu que as células-tronco se diferenciassem dentro das construções 3-D para auxiliar o crescimento de diversas co-culturas de células. Eles mostraram que as células endoteliais podem ser incluídas nos materiais bioinspirados para formar estruturas semelhantes a vasos em todas as construções de tecido. Os cientistas pretendem usar a rede semelhante à ECM como base para esforços futuros de engenharia de tecidos biológicos funcionais no laboratório.
A cultura de células de mamíferos in vitro é uma técnica experimental indispensável em pesquisas básicas e aplicações industriais, embora o processo existente dependa de plástico rígido 2-D ou superfícies de vidro por conveniência - prejudicando a resposta biológica nativa. Uma vez que as células biológicas estão naturalmente acostumadas a receber sinais do ambiente 3-D, engenheiros de tecidos formaram novas estratégias experimentais usando culturas de células 3-D. As condições experimentais mantiveram a adesão celular, proliferação e diferenciação para recriar e sustentar o metabolismo e a funcionalidade das células no laboratório.
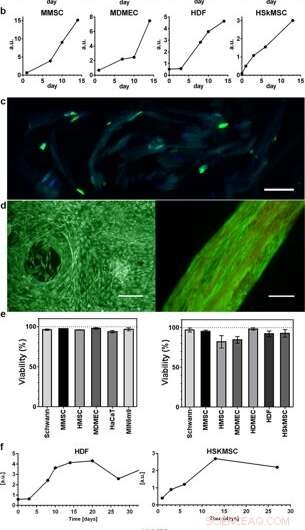
Proliferação e viabilidade de células integradas em seda 3D. Gráficos representativos do ensaio de viabilidade do azul Alamar mostram aumento da atividade metabólica durante as primeiras 2 semanas dentro de (a) espuma (N =3-4, n =3-7), e (b) fibras (N =1-9, n =2–13), refletindo o crescimento dos vários tipos de células integradas (HaCaT; linha de células de queratinócitos humanos, HDF; fibroblastos dérmicos humanos, MDMEC; células endoteliais microvasculares dérmicas de camundongo, MIN6m9; linha de células β pancreáticas de camundongo secretoras de insulina). (c) A divisão celular ocorre profundamente na seda 3D. Criosecção de uma fibra com fibroblastos integrados (HDF) fixada no dia 11 e corada com FITC-anti BrdU para DNA recém-sintetizado (verde) e DAPI (azul). A seda mostra uma fraca autofluorescência na faixa azul / verde. (d) Coloração representativa viva (verde) e morta (vermelha) de células-tronco mesenquimais de camundongo (MMSC) em espuma (esquerda) e HDF em fibra (direita) no dia 14. A fibra mostra uma autofluorescência fraca na faixa vermelha. Barras de escala =100 µm. (e) Viabilidade (%, média e desvio padrão) após 14 dias de cultura de diferentes tipos de células (ver Suppl. Tabela 1) em espuma (gráfico à esquerda), e em fibras (gráfico à direita) (N =1-3, n =4). (f) Culturas de longo tempo de células integradas em fibras mantiveram a atividade metabólica (Alamar blue) durante todo o período de estudo (até 97 dias). Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-42541-y
Anteriormente, Johansson e Widhe et al. desenvolveu um processo escalonável para desenvolver a proteína de seda de aranha recombinante conhecida como 4RepCT para cultura de células bioinspiradas em laboratório, que se automontam em microfibras biodegradáveis e biocompatíveis em aquoso, tampões fisiológicos à temperatura ambiente. Eles funcionalizaram a nova construção usando um motivo de adesão celular de fibronectina (FN) para formar o material FN-seda e promover a adesão celular firme. Embora as células tenham proliferado ao longo das novas superfícies materiais, eles permaneceram na superfície sozinhos, incapaz de proliferar nas construções para imitar adequadamente as propriedades semelhantes a tecido in vitro. No presente trabalho, os cientistas, portanto, desenvolveram um novo método, para incorporar células de forma eficiente ao material de seda durante a montagem de FN-seda para cultura de células 3-D encapsuladas e viáveis que imitou adequadamente a matriz extracelular in vitro.
Construções de seda incorporadas em células de engenharia de tecidos no laboratório
Durante os experimentos, Johansson e Widhe et al., primeiro adicionou uma gota de células-tronco dispersas (células-tronco mesenquimais de camundongo, MMSC) para a solução de proteína de seda FN antes da montagem da solução. Após a incubação, a rede recém-formada permaneceu estável nos meios de cultura e o número de células encapsuladas aumentou nas construções ao longo do período de cultura. Depois de três dias, as células se espalham por todas as dimensões da espuma, que os cientistas observaram usando microscopia de contraste de interferência diferencial (DIC).
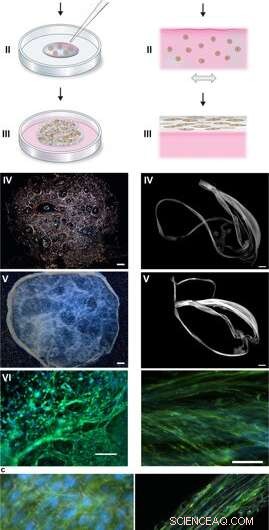
Montagem de seda para integrar células em uma rede 3D de microfibras. (a) Descrição esquemática da formação de espuma de seda com células enraizadas. As células suspensas em meio de cultura (rosa) são adicionadas a uma gota definida de solução de proteína FN-seda (azul) colocada no meio de um poço de cultura não tratado (I). As bolhas de ar são introduzidas rapidamente (5 a 10 segundos) através de uma ponta de pipeta (II), para dar origem a uma espuma 3D com células. Após 30 minutos na incubadora de células, meio de cultura adicional é adicionado para cobrir a espuma completamente (III). Dia 1 após a formulação, a espuma de seda com células parece quase transparente, embora abrigando algumas bolhas de ar remanescentes (que desaparecem com o tempo) (IV). Após 2 semanas de cultura, a espuma com células integradas mostra uma aparência mais densa e branca (V). Já no dia 3, a espuma está cheia de células bem espalhadas (aqui as células-tronco mesenquimais de camundongo (MMSC) são mostradas) (VI). Os filamentos de actina são visualizados por faloidina (verde) e os núcleos celulares por coloração DAPI (azul). Barra de escala IV-V =1 mm, VI =100 µm. (b) Descrição esquemática das fibras de seda formadas com células integradas. As células suspensas em meio (rosa) são adicionadas à solução de proteína FN-seda (azul) (I). Durante a inclinação uniaxial repetida suave por 1-3 horas (II), as proteínas da seda se reúnem na interface ar-líquido em um feixe macroscópico de microfibras com células incorporadas (III). As fibras de seda com células são facilmente recuperadas (IV) e podem ser colocadas em um poço para posterior cultura, em que a espessura aumenta em 2 semanas (V). No dia 3, células alinhadas (aqui MMSC) são encontradas espalhadas integradas no feixe de fibras (VI). Os filamentos de actina são visualizados por faloidina (verde) e os núcleos celulares por coloração DAPI (azul). Barra de escala IV-V =1 mm, VI =100 µm. (c) Micrografias de contraste de interferência diferencial (DIC) das microfibras de seda (brancas) em uma fibra (esquerda) e uma espuma (direita) com células integradas (MMSC). Os filamentos de actina são visualizados por faloidina (verde) e os núcleos celulares por coloração DAPI (azul). Barra de escala =50 µm (esquerda) e 100 µm (direita). Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-42541-y
Eles direcionaram o alinhamento celular para formar uma rede 3-D aleatória de microfibras que imitou com sucesso os tecidos biológicos, formando um feixe macroscópico de microfibras durante a linha do tempo da cultura de células, seguido pelo exame da proporção de células para ECM. Os cientistas variaram o ECM para a composição celular para imitar ou combinar uma variedade de tipos de tecido, incluindo células esparsas e tecidos de alta densidade do fígado. O método é, portanto, também adequado para cultura de células 3-D com pequenas quantidades de células.
Testando a viabilidade celular nos andaimes de seda - estudos de citocompatibilidade
Os cientistas usaram perfis de crescimento para mapear os diversos tipos de células incorporadas na espuma e nas fibras da montagem de seda. Eles observaram um aumento do sinal da atividade metabólica para representar a proliferação celular nos andaimes de seda 3-D e, com o tempo, mostraram um aumento da densidade celular no andaime celular de seda mais interno. Johansson et al. investigou a proliferação celular usando coloração de BrdU, onde os resultados positivos provaram uma proliferação mais profunda e propagação de células nas fibras de seda para manter a viabilidade celular após 2 semanas de encapsulamento, e durante períodos de cultura de células de longo prazo que duraram de um a três meses.
Comparando a citocompatibilidade de biomateriais de seda vs. hidrogel
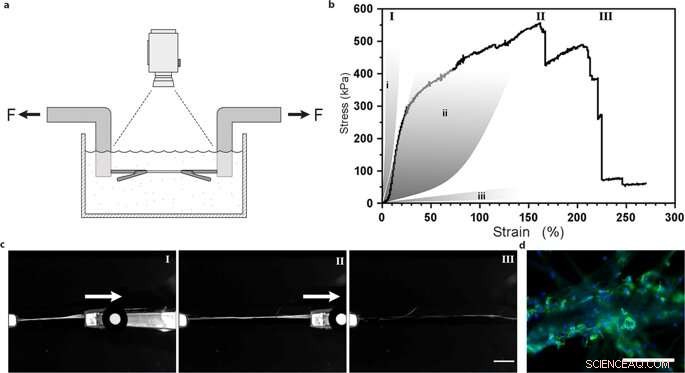
Ensaios de tração uniaxial de fibras de seda com células-tronco mesenquimais integradas. (a) Ilustração da configuração experimental para testes de tração realizados em tampão PBS a 37 ° C, a fim de manter células viáveis. (b) Curva de tensão versus tensão de Piola-Kirchhoff representativa de uma fibra de seda FN com células-tronco mesenquimais integradas (MMSC) submetidas a testes de tração após 14 dias de cultura. A curva tensão-deformação ilustra uma fase bastante linear (e provavelmente elástica) que é seguida por uma fase de deformação semelhante a plástico (irreversível) até que a tensão máxima seja atingida, e a fibra quebra. Para comparação, áreas cinzas representam faixas de propriedades de tensão de tensão em tendões e ligamentos (i), paredes das artérias (ii), e tecido cerebral (iii). Os números romanos referem-se às imagens (c) tiradas durante o teste de tração, ou seja, durante o início (I), extensão (II) e quebra (III) das fibras. Barra de escala =5 mm. (d) Micrografias do ponto de ruptura das fibras com MMSCs após o teste de tração. Os filamentos de actina são visualizados por coloração com faloidina (verde) e os núcleos das células são corados com DAPI (azul). Barras de escala =200 µm. Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-42541-y
Com base nos resultados preliminares encorajadores, os cientistas realizaram experimentos paralelos para comparar o crescimento celular em seda vs. crescimento celular em hidrogel para determinar a citocompatibilidade dos dois materiais. Eles escolheram o alginato para representar o hidrogel durante a cultura de células e observaram diferenças entre alginato e seda, registrando a expansão de células claras em seda, enquanto as células em alginato permaneceram em um estado metabólico estável. Usando microscopia confocal, eles investigaram as razões para a diferença observada no crescimento celular ao nível do microambiente. Os resultados mostraram adesão celular imediata (observada com células alongadas) nas construções de seda, enquanto os construtos de alginato se contraíram durante a cultura de células, o que pode ter estressado as células a se desprenderem.
Estudos biomecânicos - caracterizando os novos materiais
Eles determinaram que a rigidez da superfície do material era um componente crucial que afetava o destino das células. Para verificar esta observação, Johansson et al. testou o comportamento biomecânico das construções de seda para garantir que imitavam adequadamente o tecido nativo. Eles realizaram testes de tração em um buffer fisiológico para obter os resultados, que provou que as propriedades mecânicas das células contendo seda correspondiam às do tecido conjuntivo, como as paredes arteriais. Johansson et al. foram capazes de demonstrar a alta extensibilidade das microfibras para indicar a transição de força para dentro e através das células anexadas ao novo biomaterial - confirmando a adesão celular adequada.
Estudos de biofuncionalização - investigando a biocompatibilidade de superfície in vitro
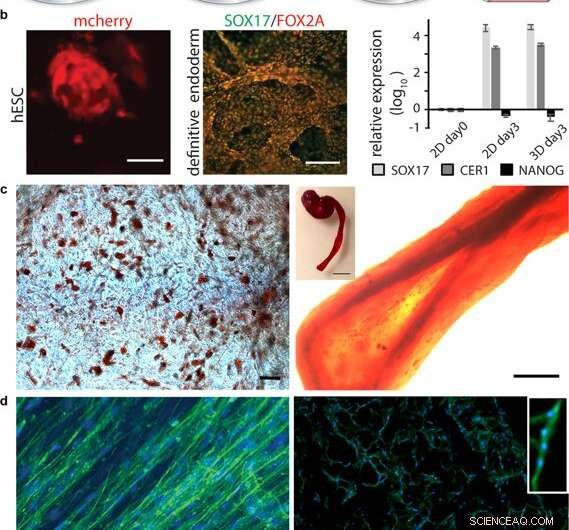
Diferenciação de células em seda 3D. (a) Após a expansão inicial das células-tronco integradas à seda 3D, a diferenciação em vários tipos de tecido pode ser desencadeada pela adição de fatores apropriados. (b) Diferenciação de células-tronco pluripotentes. Esquerda:Células-tronco embrionárias humanas (hESC) visualizadas por detecção mCherry em 48 h após a integração da célula em espuma de seda FN. Barra de escala =50 µm. Meio:imunocoloração para marcadores endodérmicos SOX17 (verde) e FOX2A (vermelho) após 3 dias de diferenciação. Barras de escala =200 µm. À direita:expressão gênica (SOX17, CER1, NANOG) de hESC em uma espuma de seda FN em comparação com a cultura 2D, analisado por RT-qPCR no dia 3 de indução endodérmica. As barras representam a variação média ± desvio padrão (n =4). (c) Diferenciação de células-tronco adultas multipotentes. Esquerda:células-tronco mesenquimais humanas (HMSC) em espuma de seda FN diferenciadas na linhagem adipogênica contendo lipídios, visualizado por coloração de óleo vermelho (vermelho) (N =2, n =4). Barra de escala =100 µm. À direita:HMSCs diferenciados na linhagem osteogênica, sondado com marcador osteogênico para conteúdo de cálcio (Alizarin Red S (vermelho) em fibra de seda FN (direita, barra de escala =200 µm), (N =2, n =4). A inserção mostra a foto de uma fibra inteira (direita), barra de escala =1 mm). (d) Diferenciação de células precursoras adultas. Esquerda:Após 14 dias em meios de diferenciação, células satélite do músculo esquelético (HSkMSC) dentro de uma fibra de seda FN mostram filamentos de actina proeminentes, conforme visualizado por coloração com faloidina (verde). À direita:Diferenciação miogênica de células satélite do músculo esquelético (HSkMSC) visualizada pela coloração de Desmina (verde). Núcleos corados com DAPI em azul. (N =9, n =4). Barras de escala =200 µm. Um close da área de um miotubo multinucleado é mostrado no canto superior direito. Crédito:Relatórios Científicos, doi:10.1038 / s41598-019-42541-y
Depois de estabelecer a estabilidade biomecânica, os cientistas testaram se as células-tronco que cresceram nos andaimes de seda poderiam se diferenciar (amadurecer) no mesmo material. Por esta, eles usaram células-tronco embrionárias humanas pluripotentes e multipotentes nos ensaios de cultura de células, seguido pela quantificação da expressão gênica de marcadores biológicos de crescimento celular; FOXA2 (genes metabólicos), SOX17 (genes para o desenvolvimento embrionário e determinação do destino celular), CER1 (antagonistas da proteína morfogenética óssea) e NANOG (proliferação de células-tronco embrionárias, pluripotência e renovação). Nos resultados, SOX17 e CER1 mostraram regulação positiva robusta, enquanto o biomarcador de pluripotência (NANOG) diminuiu devido à maturidade celular como resultado da perda de pluripotência.
Os cientistas testaram a biofuncionalização de superfície para diversos tipos de células, incluindo células satélite do músculo esquelético humano (HSkMSC) e células-tronco mesenquimais humanas derivadas da medula óssea (hMSC). Após a expansão celular nas construções, os cientistas poderiam direcionar o destino das hMSCs em linhagens celulares adipogênicas ou osteogênicas. Adicionalmente, após duas semanas de cultura de células, Johansson et al. mostraram diferenciação miogênica das HSkMSCs para formar filamentos de actina proeminentes, e expressam o marcador específico do músculo desmina, para verificar a maturação do miotubo in vitro.
Engenharia de vasos biológicos no laboratório
Os cientistas então combinaram as células endoteliais na rede vascular 3-D para formar o tecido conjuntivo que imitou a organização celular inerente de micro-vasos no laboratório. Eles seguiram o mesmo protocolo usando montagem de seda com integração de células e adicionaram uma fração de células endoteliais para projetar o tecido conjuntivo. Em duas semanas, eles observaram as células se reunirem e formarem brotos ramificados com milímetros de comprimento e estruturas semelhantes a vasos com anéis proeminentes de células endoteliais nas fibras de seda. Os cientistas poderiam aumentar o tamanho das construções em escala e determinar o alinhamento e agregação de diversos tipos de células.
Desta maneira, Johansson e Widhe et al. demonstrou uma nova estratégia e desenvolveu um protocolo para caber em células funcionais dentro de redes 3-D que imitavam a arquitetura fibrosa da matriz extracelular nativa (ECM). Para mediar o experimento, eles usaram proteínas de seda recombinantes de automontagem e mostraram que uma variedade de células poderiam ser incorporadas nas construções 3-D. A configuração e o protocolo são simples e econômicos, ao contrário da impressão 3D, o processo é frugal e prático, sem maquinários caros. Os cientistas pretendem otimizar e padronizar este protocolo para desenvolver biocompatíveis, materiais avançados de seda em engenharia de tecidos. O trabalho experimental terá uma ampla gama de aplicações na ciência dos materiais, como modelos in vitro em miniatura para o desenvolvimento de drogas e como grandes construtos de tecido de bioengenharia na medicina regenerativa.
© 2019 Science X Network