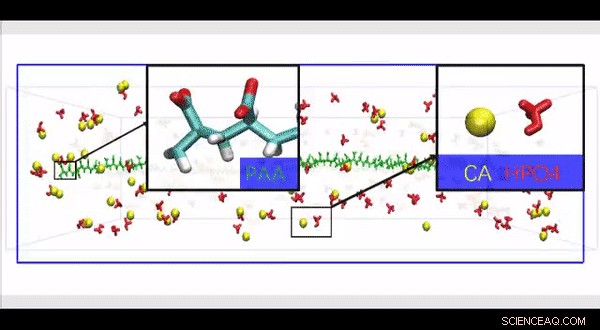
Simulação de dinâmica molecular atomística completa de uma estrutura de colágeno HPAA de alta resolução construída para investigar o efeito da presença de grandes moléculas de polieletrólitos ao longo da superfície da fibrila de colágeno no movimento e infiltração de íons em um modelo biomimético. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Os organismos vivos formam minerais biológicos durante a biomineralização, onde elementos inorgânicos podem se depositar seletivamente em macromoléculas orgânicas específicas sob controle preciso. O processo pode ser dividido em biocalcificação ou biosilicificação com base no componente inorgânico, com colágeno usado como molde universal. Durante a mineralização intrafibrilar, matrizes de colágeno destinadas à mineralização em vertebrados contêm proteínas de matriz ligadas à superfície. Compreender os mecanismos complexos de mineralização intrafibrilar para formar tecido colágeno duro, como osso e dentina, é de interesse significativo na biomecânica, com décadas de estudos conduzidos para imitar ou modelar o processo em laboratório. Em um estudo recente, agora publicado em Avanços da Ciência , Q. Song e colegas de trabalho dos Departamentos Interdisciplinares de Biologia, Física aplicada, Ciência e Engenharia de Materiais, Ciências Biomédicas e Medicina Dentária, na China, os EUA e a Itália, desenvolveram um modelo biomecânico para examinar as interações colágeno-ligante que contribuem para a mineralização intrafibrilar.
No estudo, eles usaram carga negativa, ácido policarboxílico de alto peso molecular, reticulado com colágeno reconstituído, para criar o modelo biomimético. Eles realizaram microscopia eletrônica criogênica e simulações de dinâmica molecular, para mostrar que os agregados em forma de cadeia formados após a reticulação com o colágeno, ao longo da superfície fibrilar para implementar a mineralização fibrilar. Eles observaram que a carga negativa, andaimes mineralizados permitiram-lhes alcançar maior qualidade com melhores propriedades biomecânicas, em comparação com a mineralização em andaimes não modificados. O trabalho sobre a interação colágeno-ligante forneceu aos cientistas insights sobre a origem dos tecidos mineralizados heterogeneamente e também esclareceu as causas potenciais da calcificação ectópica (biomineralização inadequada) em tecidos corporais não mineralizados.
Biominerais que ocorrem na natureza inerentemente contêm cálcio para formar fosfato de cálcio (CaP) e fosfato de octacálcio como exemplos. Biominerais contendo CaP constituem especificamente tecidos conjuntivos duros vertebrais, enquanto o carbonato de cálcio forma o esqueleto invertebral. As fibrilas de colágeno podem ser usadas como modelos de mineralização devido aos canais em nanoescala em suas estruturas fibrilares para formar híbridos projetados por nanoengenharia com resistência e resiliência combinadas. Contudo, o processo não pode ser alcançado simplesmente imergindo matrizes de colágeno em uma solução supersaturada de íons minerais, em vez disso, requer o uso de inibidores de nucleação para estabilizar complexos de associação de íons e evitar sua cristalização fora das fibrilas. Como resultado, na última década, cientistas propuseram diferentes modelos in vitro para compreender os mecanismos de mineralização intrafibrilar. Nos modelos de estudo anteriores, inibidores de nucleação de cristal foram incluídos no meio de mineralização e não ligados às fibrilas de colágeno, partindo do cenário típico que ocorre nos sistemas biológicos. No presente modelo de estudo, Song et al. portanto, permitiu que os inibidores se ligassem às fibrilas de colágeno para uma biomimética adequada.
Caracterização do colágeno PAA. (A) Espectros de infravermelho de esponjas de colágeno PAA. Os espectros foram normalizados ao longo do pico da amida de colágeno A (~ 3300 cm − 1, Estiramento NH juntamente com ligação de hidrogênio) em comparação com o espectro de colágeno puro, os espectros de colágeno ligado a HPAA (colágeno HPAA) e esponjas de colágeno ligado a LPAA (colágeno LPAA) mostram aumentos na amida B, EU, II, e III picos. (B) Superfície sólida ζ potencial de colágeno HPAA, LPAA-colágeno, e colágeno puro. A reticulação do PAA com a molécula de colágeno resultou em potenciais ζ significativamente mais baixos de -17,17 ± 1,98 mV para colágeno HPAA, −15,19 ± 1,22 mV para colágeno LPAA, e −3,04 ± 0,37 mV para o colágeno puro. (C e D) Comparação dos grupos carboxila (C) e amina (D) entre o colágeno PAA e o colágeno puro. Após a modificação aniônica, as quantidades de grupo carboxila (em mM / g de colágeno) no colágeno HPAA (1,907 ± 0,084) e colágeno LPAA (1,807 ± 0,035) foram significativamente maiores do que no colágeno puro (0,460 ± 0,017). Crédito:Science Advances, doi:10.1126 / sciadv.aav9075. 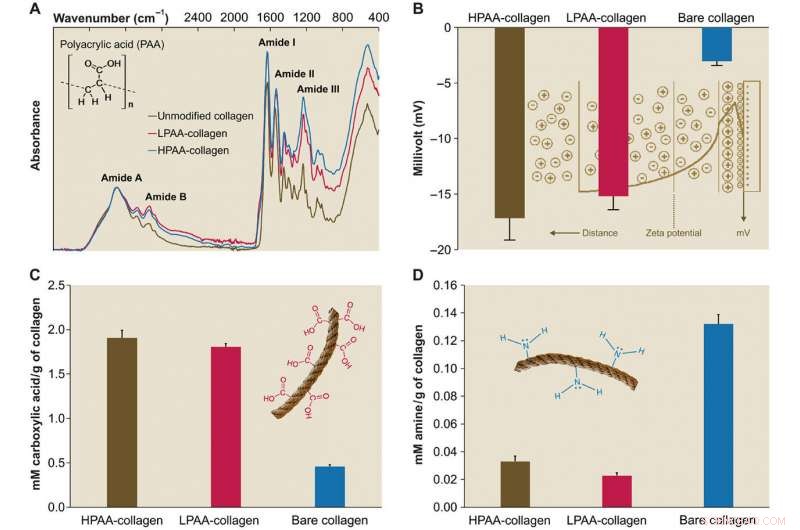
Uma vez que as proteínas fisiológicas não colágenas são difíceis de extrair e funcionalmente complexas para uso em estudos de mineralização biomimética, Song et al. usaram polieletrólitos aniônicos como inibidores de nucleação em seu modelo de mineralização intrafibrilar. Os polieletrólitos aniônicos podem imitar a conformação protéica altamente aniônica e intrinsecamente desordenada encontrada nas proteínas não colágenas. No modelo proposto, os inibidores de nucleação de polieletrólitos ligados ao colágeno reconstituído sem proteína da matriz como modelos de mineralização intrafibrilar. Song et al. primeiro simularam a dinâmica molecular para mostrar que um polieletrólito, como o ácido poliacrílico (PAA), poderia reservar complexos de íons de cálcio e fosfato de hidrogênio em agregados semelhantes a cadeias ao longo da superfície da macromolécula após sua introdução em um meio de mineralização CaP supersaturado.
Com base na dinâmica molecular simulada, Song et al. desenvolveram uma hipótese de teste de que um inibidor de nucleação ligado à superfície das fibrilas de colágeno poderia estabilizar os precursores de mineralização de CaP perto das fibrilas, para mineralização intrafibrilar eficiente. Para testar a hipótese, eles usaram controles com uma versão não ligada do mesmo polieletrólito usado para estabilizar os precursores de CaP incluídos no meio de mineralização.

Simulando a fase tardia da mineralização intrafibrilar do colágeno HPAA. Renderização 3D da fase tardia da mineralização intrafibrilar de colágeno HPAA mostrando o acúmulo de agregados de aglomerados de pré-enucleação (amarelo) ao longo da superfície da fibrila; minerais intrafibrilares são representados em laranja. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Os cientistas usaram o ácido poliacrílico de alto peso molecular - PAA (HPAA) para simular a osteopontina e o PAA de baixo peso molecular (LPAA) para simular a osteocalcina. Eles reticularam quimicamente os eletrólitos polianiônicos para reconstituir fibrilas ou esponjas de colágeno tipo I usando compostos orgânicos e examinaram a constituição do polímero usando espectroscopia de infravermelho com transformada de Fourier (FTIR). Song et al. usaram microscopia eletrônica de transmissão (TEM) para observar fibrilas de colágeno ligadas ao PAA que foram coradas de vermelho e as registrou como agregados filamentosos densos de elétrons na superfície da fibrila. Eles então usaram a cromatografia líquida de alto desempenho para examinar as características de ligação / liberação de esponjas de colágeno PAA.
Simulando a dinâmica molecular da biomineralização
Para compreender as diferentes fases da mineralização intrafibrilar do colágeno ligado a HPAA (colágeno HPAA), os cientistas criaram filmes usando os dados da tomografia eletrônica das diversas fases da biomineralização. Eles simularam a (1) fase inicial - para mostrar o acúmulo de agregados do cluster pré-enucleação em torno da fibrila de colágeno não mineralizada, (2) fase intermediária - para mostrar mineralização intrafibrilar parcial e (3) fase tardia - para mostrar mineralização intrafibrilar pesada das fibrilas de colágeno HPAA. Eles mostraram que o colágeno LPAA não induziu mineralização intrafibrilar em comparação com o HPAA no estudo, e, portanto, não incluiu os polímeros nas experiências subsequentes.

Simulações de dinâmica molecular. (A) Perfil de estruturas microfibrilares de colágeno nu com moléculas de água dentro dos espaços intrafibrilares. Fitas azuis, hélices triplas de colágeno; pontos vermelhos, moléculas de água. (B) Vista lateral de microfibrilas de colágeno expostas. As linhas azuis descrevem a caixa de simulação de 67 nm de comprimento. (C e D) Movimento de Ca2 + (esferas amarelas), HPO42− (conjuntos vermelhos), e precursores de mineralização CaP montados (conjuntos amarelo-vermelho) através das microfibrilas de colágeno com o HPAA (cadeia verde) ligado aos aminoácidos LYS1099 das moléculas de colágeno. (E) Topo:Simulação do movimento de vários íons através das estruturas microfibrilares de colágeno HPAA em tempos de simulação designados. Esferas azuis, esferas roxas, esferas amarelas, montagem vermelha, conjuntos amarelo-vermelho, e a estrutura da cadeia verde representa íons Na +, Cl− ions, Íons Ca2 +, HPO42− íons, Precursores de mineralização CaP, e HPAA, respectivamente. Abaixo:mudanças dinâmicas no número de Ca2 + (linha preta), HPO42− (linha vermelha), Na + (linha verde), e Cl− (linha azul) nas regiões intrafibrilar e extrafibrilar ao longo do limite do eixo a em 0, 30, 50, e 70 ns. (F) Movimento de Ca2 +, HPO42−, e precursores de mineralização CaP montados através das microfibrilas de colágeno exposto com HPAA não ligado na região extrafibrilar (controle). (G) Comparação da distribuição de vários íons dentro da região intrafibrilar nos modelos de mineralização HPAA ligado ao colágeno e HPAA não ligado. (H) Comparação da raiz média do desvio quadrático de moléculas de colágeno nos modelos HPAA ligado ao colágeno e HPAA não ligado. (I) Comparação da área de superfície acessível ao solvente (SASA) das moléculas de colágeno entre os dois modelos. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Song et al. posteriormente usou simulações de dinâmica molecular do processo de mineralização para entender a relação estrutura-função e validou a capacidade de HPAA ligado ao colágeno para agregar precursores de mineralização CaP. Por esta, eles usaram um modelo atomístico completo do complexo de fibrila de colágeno HPAA hidratado. No modelo da unidade, eles simularam Ca 2+ e HPO 4 2- íons e precursores de mineralização CaP montados para formar em torno do HPAA ligado ao colágeno. O trabalho revelou a distribuição de íons de sódio, cloreto, cálcio e HPO 4 2- íons ao longo do eixo do limite do modelo de unidade.
Examinando a ultraestrutura
Para exames ultraestruturais do modelo biomimético, Song et al. usaram nanoindentação para avaliar os módulos de Young de fibrilas de colágeno mineralizadas e não mineralizadas com microscopia de força atômica (AFM). Os valores foram semelhantes aos relatados anteriormente para fibrilas mineralizadas e não mineralizadas, computado usando nanoindentação. Os cientistas usaram espectroscopia de difração de raios-X para identificar a presença de apatita nas esponjas mineralizadas. O estudo mostrou que o colágeno HPAA mineralizado em solução de CaP por sete dias tinha maior conteúdo mineral do que o colágeno puro. Quando Song et al. calculou a relação apatita / colágeno nos perfis espectroscópicos, as esponjas de colágeno HPAA indicaram níveis mais elevados de mineralização.
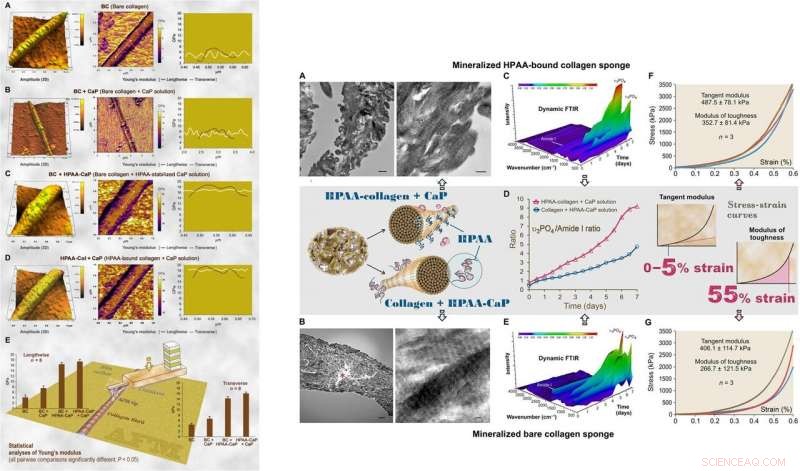
:ESQUERDA:AFM da topografia da superfície 3D e mapeamento do módulo de elasticidade (módulo de Young) de representante seco ao ar, colágeno nu mineralizado e fibrilas de colágeno HPAA. (A) Fibrilas de colágeno puro (BC) tiveram uma distribuição próxima ao normal do módulo de Young transversalmente através da fibrila. (B) Colágeno puro mineralizado em solução de CaP sem inibidor de nucleação (BC + CaP). (C) Colágeno puro mineralizado com solução HPAA-CaP (BC + HPAA-CaP). (D) HPAA-colágeno mineralizado com solução de CaP sem inibidor de nucleação (HPAA-Col + CaP). (E) Análises estatísticas do módulo de Young da fibrila de colágeno nas direções longitudinal e transversal (n =8). À DIREITA:Caracterização de esponjas de colágeno HPAA mineralizadas e esponjas de colágeno puro. (A) TEM de esponjas de colágeno HPAA mineralizadas. (B) TEM de esponjas de colágeno nu mineralizadas. (C) Reflexão total atenuada dinâmica (ATR) –FTIR mostra mineralização progressiva de uma esponja de colágeno HPAA em intervalos de 12 horas ao longo de um período de 7 dias. (D) Mudanças na proporção de apatita υ3PO4 / amida de colágeno I de esponjas de colágeno aniônico mineralizado e esponjas de colágeno não modificadas. E) O ATR-FTIR dinâmico mostra o progresso da mineralização de uma esponja de colágeno nua em solução HPAA-CaP. (F) Resposta de tensão-tensão de esponjas de colágeno HPAA mineralizadas para determinar o módulo tangente e o módulo de tenacidade (inserção, linha do meio). (G) Resposta de estresse-cepa de esponjas de colágeno nu mineralizado. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
O módulo de resistência, que normalmente indica a energia por unidade de volume que um material pode absorver antes de se romper, também foi significativamente maior para esponjas de colágeno HPAA, indicando resistência à fratura do material. Essas características são responsáveis pela alta resiliência dos tecidos à base de colágeno biomineralizado que mimetizam a microarquitetura óssea para combinar as propriedades ósseas de resistência e resistência na engenharia regenerativa. Song et al. creditaram as propriedades observadas de coesão / adesão à reticulação HPAA, que permitiu criar o composto de colágeno / mineral, semelhante à osteopontina reticulada encontrada na arquitetura óssea.
Aplicações das novas construções biocompatíveis
Uma vez que a biocompatibilidade de novos materiais é uma característica importante na ciência dos materiais e bioengenharia, Song et al. verificaram interações células-material favoráveis no colágeno reticulado por HPAA usando a viabilidade e proliferação de células-tronco durante a cultura de células de regeneração óssea em laboratório. Quando os cientistas realizaram ensaios de desidrogenase mitocondrial e apoptose em células-tronco mesenquimais humanas, eles não observaram diferenças significativas entre o colágeno HPAA não mineralizado e as esponjas de colágeno puro. Devido à sua compatibilidade com células semelhantes a osteoblastos humanos, tais materiais podem ser usados como revestimentos biocompatíveis para implantes cirúrgicos.
Desta maneira, Song et al. demonstraram um modelo biomecânico de aumento da mineralização intrafibrilar usando interações colágeno-ligante para entender os mecanismos específicos do local. Este modelo de interações colágeno-ligante também pode lançar luz sobre as causas potenciais da mineralização ectópica, que é de interesse no momento. Na perspectiva de Song et al., a mineralização intrafibrilar por meio de interações colágeno-ligante pode infiltrar minerais de forma mais consistente em matrizes de colágeno em massa para aplicações em medicina regenerativa. Os resultados ajudarão a entender as propriedades biomecânicas, enquanto reduz as falhas para aumentar as características biomiméticas de uma matriz de colágeno mineralizado na engenharia de tecidos.
© 2019 Science X Network