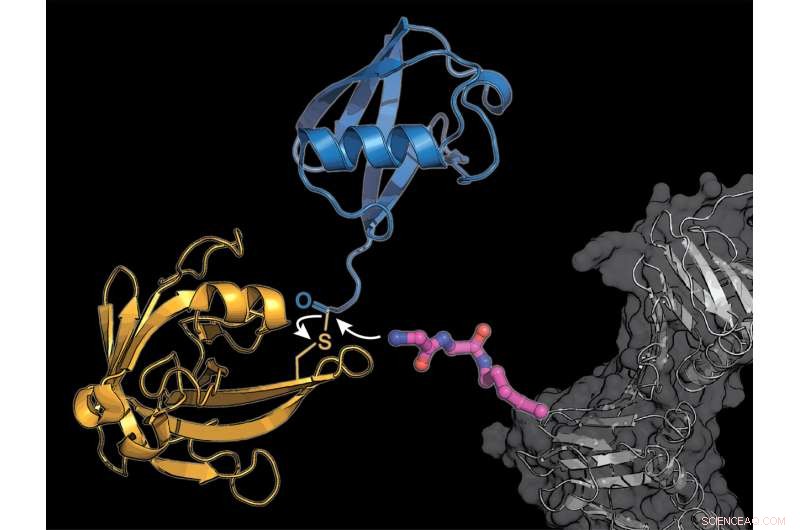
Os pesquisadores equiparam uma proteína celular (cinza) com um bloco de construção de aminoácido lisina modificado (rosa), para o qual a enzima bacteriana sortase (amarela) transmite uma molécula de ubiquitina (azul). Crédito:K. Lang / TUM
As células humanas possuem um sistema regulatório sofisticado que consiste em rotular proteínas com a pequena molécula ubiquitina. Em um primeiro, uma equipe da Universidade Técnica de Munique (TUM) conseguiu marcar proteínas com ubiquitina de maneira direcionada em tubos de ensaio e também em células vivas. O procedimento abre a porta para explorar o funcionamento interno desse sistema regulatório vital.
Plantas, fungos, animais e humanos expressam a proteína ubiquitina. Compreende uma sequência de 76 aminoácidos, tornando-se uma biomolécula relativamente pequena. Mas sua influência é de longo alcance:o tipo, a posição e o número de moléculas de ubiquitina ligadas às proteínas determinam sua estabilidade, função, e localização dentro da célula.
"Praticamente todos os processos na célula são direta ou indiretamente afetados pela ubiquitina. É por isso que o mau funcionamento desse mecanismo de marcação está associado ao desenvolvimento e progressão do câncer e de muitas outras doenças graves, "explica Kathrin Lang, Professor de Bioquímica Sintética na Universidade Técnica de Munique.
A descoberta do importante papel que este sistema regulatório celular desempenha na degradação controlada de proteínas foi reconhecida com o Prêmio Nobel de Química de 2004. Mas, em muitos casos, os detalhes de como as modificações da ubiquitina afetam a função das células permanecem obscuros. A equipe de Kathrin Lang desenvolveu agora um método para anexar rótulos de ubiquitina a proteínas-alvo - uma chave para explorar o sistema.
Uma enzima bacteriana cria novos compostos
A equipe de Lang usa dois truques para contornar o complicado sistema natural:eles incorporam um novo aminoácido modificado, no qual a enzima sortase derivada de bactérias pode anexar ubiquitina ou uma molécula semelhante à ubiquitina.

Primeiro autor Maximilian Fottner e Prof. Kathrin Lang em seu laboratório. Crédito:Andreas Battenberg / TUM
"O maior desafio foi alinhar as várias etapas - a incorporação do aminoácido não natural em uma proteína-alvo e a transferência de ubiquitina pela enzima sortase - de forma que funcionem não apenas no tubo de ensaio, mas também na vida células, "lembra Maximilian Fottner, o principal autor do estudo.
Enquanto isso, os pesquisadores da Universidade Técnica de Munique otimizaram e patentearam seu novo método para muitas proteínas celulares diferentes. "Já firmamos colaborações com médicos e biólogos celulares que agora querem trabalhar conosco para estudar os efeitos dos marcadores de ubiquitina no desenvolvimento de câncer e doenças neurodegenerativas como o Parkinson em nível molecular, "diz o Prof. Lang.