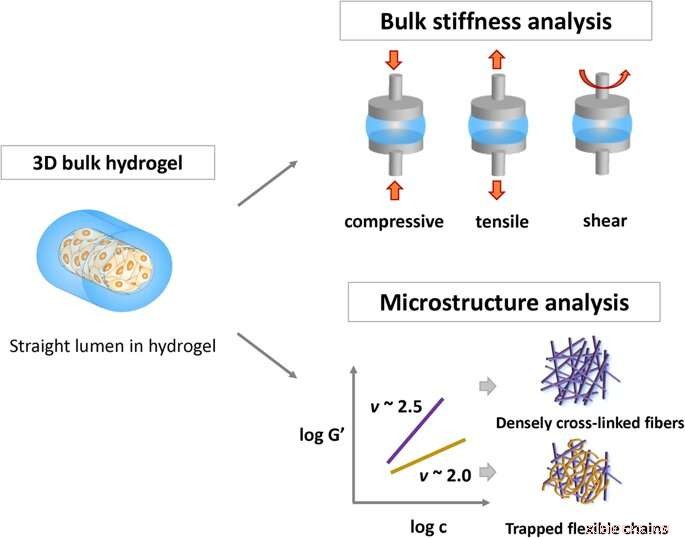
Representação esquemática de métodos de caracterização das propriedades físicas do hidrogel:a rigidez do hidrogel e a flexibilidade da cadeia em redes viscoelásticas através do modelo semiflexível. Crédito: Relatórios Científicos , doi:https://doi.org/10.1038/s41598-019-38951-7
Os hidrogéis são comumente utilizados como biomateriais para aplicações em biomedicina devido à sua biocompatibilidade. Contudo, a relação entre as células biológicas e a superfície do hidrogel ainda não está clara e os parâmetros existentes para explicar as interações não são sofisticados o suficiente. Em um estudo recente, Jooyoung Lee, Boa Song e colegas de trabalho do Centro de Biomateriais e do Departamento de Engenharia de Polímeros da República da Coréia estudaram o impacto da flexibilidade da cadeia de polímero na adesão celular, com uma variedade de construções de hidrogel compostas de polímeros naturais de colágeno e fibrina.
Eles introduziram um novo método de semiflexível, análise baseada em modelo para confirmar que a flexibilidade da cadeia mediou a microestrutura do hidrogel como um fator crítico que permitiu a adesão celular na interface célula-material. A análise proposta no estudo é capaz de predizer com maior precisão a biocompatibilidade (citocompatibilidade) dos hidrogéis. Resultados do trabalho agora publicados em Relatórios Científicos, fornecem um critério importante para o projeto e desenvolvimento de polímeros, aumentando a biocompatibilidade e a biofuncionalização na interface célula-material para aplicações biomédicas in vivo.
Os hidrogéis são feitos de redes poliméricas inchadas com água e têm aplicações na administração de medicamentos e na engenharia de tecidos. A adesão célula-material é crucial para a biocompatibilidade in vivo e a maioria dos estudos testou o comportamento celular analisando a rigidez da composição dos materiais. No entanto, a comunicação entre as células na superfície do hidrogel ainda precisa ser entendida com precisão. O FDA aprovou polímeros naturais de colágeno e fibrina, fornecem excelente biocompatibilidade para aplicações biomédicas. Também conhecidos como polímeros semiflexíveis, eles não estão em conformidade com os modelos de soluções de corrente flexível ou redes de haste rígida. O modelo semiflexível permite a previsão da flexibilidade da cadeia de redes poliméricas escalando experimentalmente o módulo de platô elástico.
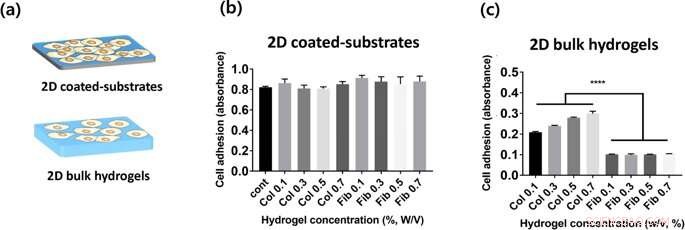
(a) Representação de 2 tipos de construções de hidrogel avaliadas neste estudo. (b, c) Adesão de células HUVEC em géis de colágeno e fibrina nas superfícies superiores de placas revestidas com hidrogel 2D (b) e hidrogel em massa (c), que é medido pelo ensaio CCK-8 2 horas após a semeadura. Crédito: Relatórios Científicos , doi:https://doi.org/10.1038/s41598-019-38951-7
No novo estudo, Lee e Song et al. propôs um novo, análise semiflexível baseada em modelo para entender a adesão celular a hidrogéis usando o colágeno bem caracterizado e polímeros de fibrina. Eles usaram três constituintes diferentes de colágeno e fibrina, para investigar os fatores que determinam a adesão celular:
Os cientistas variaram a concentração de hidrogel nos constituintes do material de 1 mg / mL a 7 mg / mL e quantificaram a rigidez e aspereza dos biomateriais recém-formados. Para definir os parâmetros de fixação da célula, eles observaram a morfologia da cadeia dos novos materiais. Os resultados confirmaram que a microarquitetura dos hidrogéis afetou a flexibilidade da cadeia como um fator crucial que afeta a adesão celular.
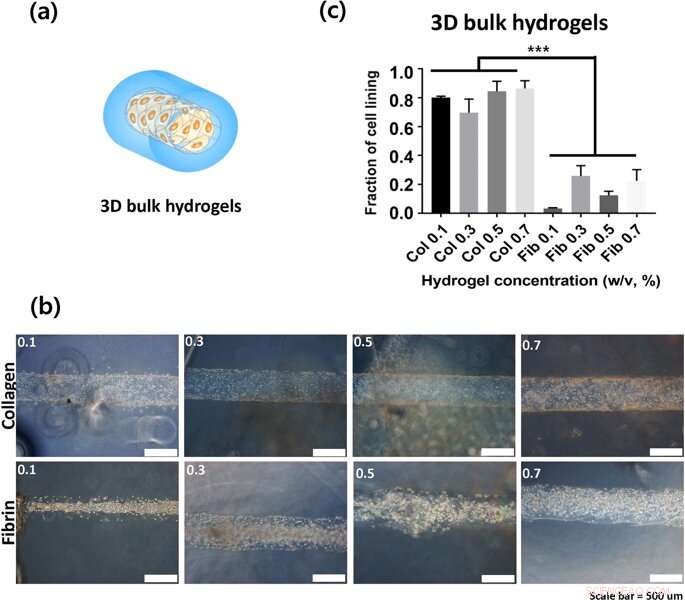
(a) Representação de construções de hidrogel em massa 3D (b) A superfície interna de canais ocos em que as imagens foram capturadas 24 horas após a semeadura. (c) A fração do revestimento celular como quantificação da adesão celular. Crédito: Relatórios Científicos , doi:https://doi.org/10.1038/s41598-019-38951-7
Na configuração experimental, os cientistas prepararam uma variedade de construções de colágeno e fibrina, para testar a adesão celular sem efeitos da gravidade. Eles controlaram a rigidez do hidrogel usando concentrações incrementais de cada componente e quantificaram a relação tensão-deformação com base nas tensões axial (tração ou compressão) e rotacional (cisalhamento). Para medir as propriedades reológicas dos hidrogéis, os cientistas usaram um reômetro controlado por estresse. Eles então mediram o módulo de compressão para teste de tração com uma máquina de teste universal. Para investigar a topografia da superfície, os cientistas usaram um microscópio de força atômica, seguido de microindentação para medir o módulo de Young (E) dos hidrogéis, onde calcularam a média (E) usando o software de processamento de dados JPK. Lee e Song et al. acreditam que o estudo foi o primeiro a investigar a adesão celular em hidrogéis usando a inclinação da elasticidade do modelo de polímeros semiflexíveis.
Para cultura de células no laboratório, Lee e Song et al. usaram células endoteliais da veia umbilical humana (HUVECs) como a linha celular preferida. Eles mediram a taxa de adesão celular em diversas concentrações de hidrogéis de colágeno e fibrina em 2-D, e quantificou a adesão celular usando o kit de contagem de células 8 (CCK-8). Os cientistas não observaram uma diferença estatisticamente significativa entre a adesão celular em colágeno 2-D e substratos revestidos de fibrina; possivelmente, uma vez que as células detectaram as propriedades mecânicas das placas de cultura de células, em vez de propriedades materiais dos hidrogéis. Em superfícies de hidrogel em massa 2-D, a adesão celular ao colágeno (géis em massa 2-D) foi muito maior do que em géis em massa de fibrina 2-D. Além disso, à medida que a concentração de hidrogel variava, os cientistas observaram que a fixação das células aumentava sistematicamente com o aumento da concentração de colágeno. Em comparação, a adesão celular em géis de fibrina foi independente da concentração do hidrogel incorporado.
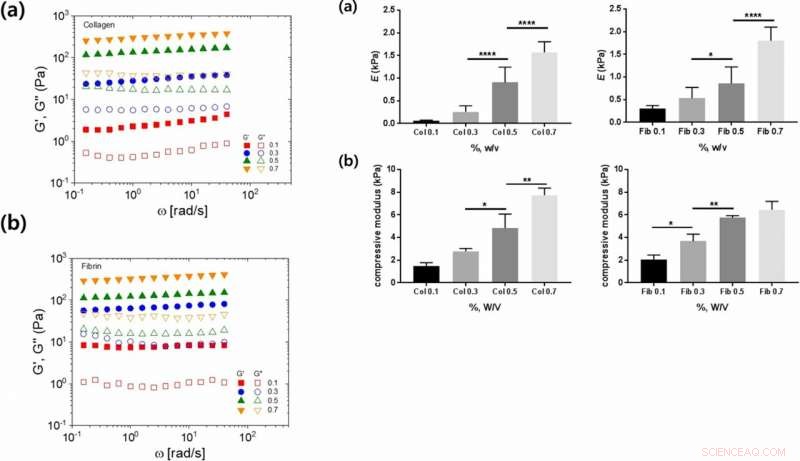
Esquerda:Propriedades viscoelásticas lineares de hidrogéis de colágeno e fibrina em função de várias concentrações de hidrogel:(a, b) dependência da frequência angular de armazenamento (G ′, símbolos preenchidos) e perda (G ″, símbolos abertos) módulos para (a) colágeno e (b) hidrogéis de fibrina. À direita:Propriedades mecânicas de colágeno e hidrogéis de fibrina em várias concentrações:(a) Young e (b) módulo de compressão em função da concentração de colágeno ou gel de fibrina. Crédito: Relatórios Científicos , doi:https://doi.org/10.1038/s41598-019-38951-7
Lee e Song et al. em seguida, usou estruturas de lúmen 3-D de hidrogéis para esclarecer a taxa de adesão celular em géis de colágeno e fibrina. Eles observaram que as células estavam melhor ligadas ao colágeno em comparação com os géis de fibrina. Os fenótipos de adesão celular também foram muito mais claros nas construções 3-D em comparação com os anexos em 2-D. Tipicamente, as células se fixam às superfícies do material ou à matriz extracelular (ECM) por meio de pontos de ancoragem conhecidos como aderências focais. As células em substratos mais rígidos geralmente contêm citoesqueletos bem organizados para aderências focais estáveis. Para entender se os hidrogéis a granel podem contribuir para a adesão celular, os cientistas representaram graficamente a rigidez dos hidrogéis e compararam o colágeno e a fibrina em diferentes concentrações. Lee e Song et al. assim, experimentalmente mostrou que a rigidez do volume não era um fator crítico para impactar a adesão das células aos hidrogéis.
Os cientistas determinaram o módulo de Young e o módulo de compressão como propriedades mecânicas adicionais dos materiais que influenciam a adesão celular. Eles mostraram como a rigidez aumentou com o aumento da concentração, e a flexibilidade da cadeia sugerida como um parâmetro apropriado. Apesar do aumento da rigidez com o aumento da concentração de colágeno e fibrina, os cientistas não conseguiram explicar as taxas de adesão celular variáveis observadas entre os dois polímeros.
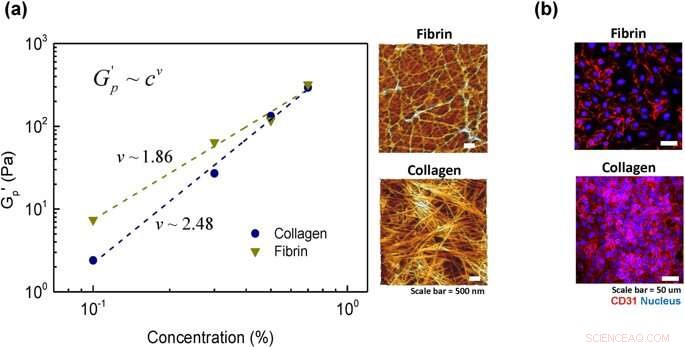
Análise da flexibilidade da cadeia do hidrogel:(a) escalonamento da lei de potência do módulo de platô com uma concentração de hidrogel para colágeno e fibrina. As linhas tracejadas são os resultados de ajustes à equação da lei de potência G'p =cv e microestrutura de duas amostras representativas de 0,5% de concentração cada em colágeno e fibrina. (b) marcador de superfície celular, CD31, após as células semeadas por 2 horas para duas amostras representativas de colágeno e fibrina (concentração de 0,5%). Crédito: Relatórios Científicos , doi:https://doi.org/10.1038/s41598-019-38951-7
Por esta, Lee e Song et al. examinou a arquitetura das moléculas de fibra e suas redes na escala microscópica usando microscopia de força atômica. Os géis de colágeno exibiram uma estrutura fibrosa, conforme relatado antes, com forma de haste bem definida, filamentos semiflexíveis. Em comparação, na estrutura do gel de fibrina, os cientistas observaram apenas alguns filamentos semiflexíveis, onde a proteína associada foi emaranhada como cadeias flexíveis presas dinamicamente. Para confirmar o grau de ligação da célula ao hidrogel, os cientistas coraram as células com o marcador de superfície celular CD31 (glicoproteína expressa nas células endoteliais) e confirmaram a arquitetura estável do endotélio no material.
Os cientistas observaram que a adesão celular total ao hidrogel de colágeno foi maior do que ao hidrogel de fibrina. Os resultados foram devido à maior rigidez do colágeno na escala microscópica, em comparação com a arquitetura de cadeia relativamente flexível de fibrina. Os cientistas, portanto, mostraram a rigidez microscópica dos hidrogéis como um fator dominante que determinava o grau de fixação da célula na superfície de um biomaterial.
Desta maneira, Lee e Song et al. métodos analíticos propostos no estudo para descrever a interação entre a adesão celular e as superfícies dos materiais. Os resultados fornecerão diretrizes significativas durante o projeto de biomateriais no futuro, ao mesmo tempo que integra propriedades de material otimizadas de durabilidade e resistência mecânica para aplicações de hidrogel in vivo. Os cientistas demonstraram um semiflexível, explicação baseada em modelo de adesão celular a biomateriais estudando a rigidez do tecido para controlar a adesão celular, proliferação e diferenciação nas construções materiais. Os autores propõem que este método simples pode explicar as propriedades de adesão celular em biomateriais poliméricos para previsões precisas de biocompatibilidade. Os resultados fornecerão uma ferramenta prática para projetar e construir tecido artificial 3-D com maior precisão biomecânica e biocompatibilidade para uma variedade de aplicações, como a bioengenharia de vasos sanguíneos e mecanismos de distribuição de drogas in vivo.
© 2019 Science X Network