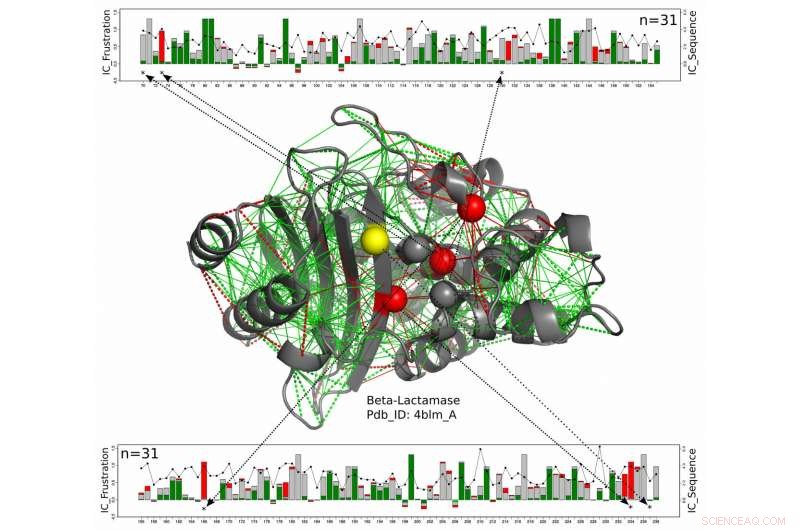
Neste modelo estrutural para uma proteína beta-lactamase, os resíduos catalíticos são mostrados como esferas com aqueles que são consistentemente altamente frustrados ao longo de toda a família da beta-lactamase mostrados em vermelho e aqueles para os quais o estado de frustração não é conservado em amarelo. O novo trabalho de cientistas da Rice University, a Universidade de Buenos Aires e o Laboratório Europeu de Biologia Molecular sugerem essas enzimas, que devem permanecer expostos para reagir com seus alvos, obter uma medida de proteção dos aminoácidos um tanto frustrados ao seu redor. As linhas verdes representam frustração mínima, as linhas vermelhas representam alta frustração. Os gráficos lineares na parte superior e inferior mostram as posições dos aminoácidos relevantes na cadeia de proteínas e uma medida da conservação de energia em toda a família de proteínas beta-lactamases. Crédito:Maria Feiberger / Universidade de Buenos Aires
As proteínas se dobram de acordo com um script escrito no padrão de seus aminoácidos. Mas para funcionar corretamente, algumas partes devem ser improvisadas.
Os sítios ativos das enzimas, proteínas que aceleram e guiam as reações bioquímicas, tornar a vida possível. Para fazer isso, suas instruções devem entrar em conflito com o plano estrutural geral da proteína, de acordo com cientistas da Rice University, a Universidade de Buenos Aires e o Laboratório Europeu de Biologia Molecular em Heidelberg, Alemanha.
De acordo com os pesquisadores, a evolução selecionou partes de enzimas como sendo importantes o suficiente para permitir o desvio energético das instruções que levam a um funil de dobramento, que orienta as proteínas em seus estados funcionais de baixa energia. Ao pesquisar essencialmente todas as enzimas conhecidas, os pesquisadores também confirmaram a suspeita de que níveis adicionais de interações fracamente frustradas cercam e apóiam os próprios sítios catalíticos.
A teoria detalhada nos Proceedings of the National Academy of Sciences estende o princípio aceito de frustração mínima que explica por que as proteínas podem progredir suavemente das sequências lineares originalmente codificadas em seu DNA para seu funcionamento, formas globulares tridimensionais. Esse princípio reconhece o fato de que a frustração geralmente não é resolvida quando o conflito energético remanescente de alguma forma serve à função da proteína.
De acordo com Peter Wolynes de Rice, que enunciou o princípio de forma matemática há mais de 20 anos, as paisagens de energia das proteínas com partes catalíticas valem uma análise extra, dada a importância que a evolução lhes atribuiu.
"Uma molécula perfeitamente dobrada, não importa quão bela seja uma escultura, não posso fazer muito, "ele disse." Você tem que ter uma proteína que, enquanto está quase dobrado, ainda tem algumas dobradiças frustradas que são incompatíveis com a dobra, mas são necessárias para permitir o movimento necessário para as reações químicas. "
A frustração no nível atômico é simples de sentir:basta empurrar os pólos positivos de dois ímãs juntos e sentir como eles empurram para trás. Como ímãs, os aminoácidos de uma proteína dobrável atraem-se e repelem-se à medida que (principalmente) resolvem conflitos e, finalmente, formam um arranjo estável de contatos.
"Agora adicione um terceiro ímã, e você pode encontrar frustração da qual não consegue se livrar, "disse o co-autor Wolynes, que trabalhou com a equipe de Buenos Aires liderada pelo químico biológico Diego Ferreiro, um ex-pesquisador de pós-doutorado em seu grupo.
O novo estudo mostra que a frustração entre os aminoácidos vizinhos da enzima, como na situação com o terceiro ímã, age para ajudar a enzima frustrada a se manter firme. Ele permanece um pouco instável, mas tem regiões disponíveis para se ligar e modificar as moléculas alvo.
Claramente, Wolynes disse, a evolução tem prioridades que superam a estética de se conseguir uma dobra perfeita.
A equipe de pesquisa pesquisou computacionalmente centenas de estruturas de proteínas conhecidas e descobriu que famílias inteiras de enzimas compartilham assinaturas características de frustração do local ativo que se estendem à segunda e terceira camadas de aminoácidos, ou conchas, em torno da enzima.
"O interessante que descobrimos foi que a frustração geralmente se estende além da primeira camada absoluta, ", disse ele." Isso significa que há uma sutileza incômoda, mas necessária, nas restrições funcionais que exigem acertar esses três invólucros.
Wolynes observou que a laureada com o Nobel Frances Arnold e outros que estudam a evolução artificial em laboratório viram evidências de uma grande frustração em seus esforços para modificar enzimas para novas reações.
"Às vezes, eles mudavam especificamente o sítio ativo para catalisar reações químicas diferentes das naturais, mas descobriram que os aminoácidos distantes do sítio ativo também precisavam ser alterados para fazer a enzima funcionar de maneira eficiente, "disse ele." Não era óbvio por que, mas os modelos mostram que mudanças na segunda e terceira camadas melhoram a capacidade catalítica das enzimas.
"Portanto, nossos resultados não foram um choque completo, mas é bom ver que a frustração prolongada é bastante prevalente na natureza e é um tema comum em todas as classes de enzimas conhecidas, " ele disse.