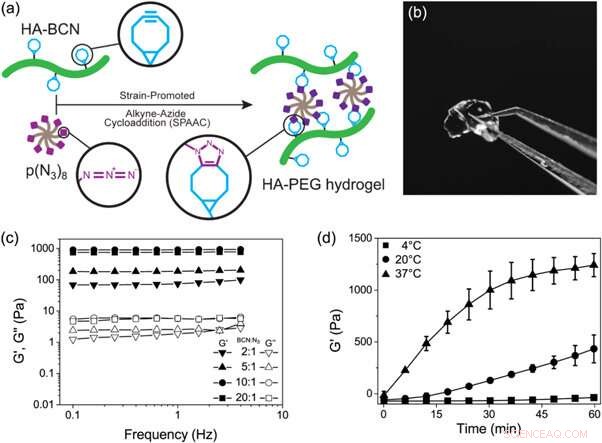
(a) Representação esquemática da formação de hidrogéis de HA-PEG através de uma reação de cicloadição alcino-azida promovida por cepa. (b) Fotografia de um hidrogel HA-PEG após a formação. (c) Varreduras de frequência de hidrogéis HA-PEG com diferentes razões BCN para N3. (d) Experiência de tempo de gelificação mostrando o aumento de G 'ao longo do tempo durante a gelificação de hidrogéis HA-PEG (10:1 BCN:N3) em diferentes temperaturas. Crédito: Biofabricação , doi:https://doi.org/10.1088/1758-5090/aaf657
Dispositivos de cultura de células Liver-on-a-chip são modelos biomiméticos atraentes na descoberta de drogas, pesquisa em toxicologia e engenharia de tecidos. Para manter funções específicas das células do fígado em um chip no laboratório, tipos de células e condições de cultura adequados devem ser atendidos, que inclui orientação de células 3D e um fornecimento consistente de nutrientes e oxigênio. Em comparação com as técnicas convencionais de cultura de células 2D, os dispositivos organ-on-a-chip oferecem versatilidade e biomimética eficaz, adequada para aplicações avançadas na descoberta de medicamentos e na medicina.
Em um estudo recente agora publicado em Biofabricação , Jonas Christoffersson e colegas demonstraram como os hidrogéis que imitam a matriz extracelular podem apoiar a funcionalidade e a viabilidade dos hepatócitos em um dispositivo de fígado em um chip perfundido. Os pesquisadores interdisciplinares na divisão de biotecnologia e física molecular projetaram um sistema de hidrogel baseado em polímeros de hialuronana e poli (etilenoglicol) (HA-PEG). Eles desenvolveram os hidrogéis usando a química do clique. Para habilitar o processo, os cientistas conduziram uma reação bi-ortogonal (química que ocorre dentro de sistemas vivos sem a interferência de reações bioquímicas nativas) entre uma porção ciclo-octina e um parceiro de reação marcado com azida alcina, conhecido como cicloadição alcino azida promovida por cepa (SPAAC).
Os novos materiais de hidrogel foram projetados e caracterizados em comparação com os hidrogéis de agarose e alginato existentes para compatibilidade celular (citocompatibilidade). Para estudos de biofuncionalização, os pesquisadores usaram hepatócitos derivados de células-tronco pluripotentes induzidas por humanos (hiPS-HEPs). Para melhorar a citocompatibilidade de superfície do biomaterial, Hidrogéis HA-PEG foram alterados com motivos de adesão celular modificados com azida para facilitar ligações eficazes de material celular. No biomaterial funcionalizado de superfície, as células-tronco dos hepatócitos migraram e cresceram em orientações 3D, com maior viabilidade. Os cientistas observaram uma maior produção de albumina no novo material (proteína característica do fígado), em comparação com células cultivadas em outros hidrogéis. O flexível, O sistema de hidrogel reticulado SPAAC com cultura de células 3D perfundidas de hiPS-HEPs é um material promissor para otimizar dispositivos liver-on-a-chip.
Biorreatores miniaturizados conhecidos como 'organ-on-chips', surgiram recentemente como modelos alternativos de cultura de células que melhor imitam o microambiente biológico in vivo no laboratório. O fígado é um modelo de especial interesse na pesquisa médica devido à hepatotoxicidade observada em todas as fases do desenvolvimento clínico de um medicamento. Publicações anteriores detalham o uso de organ-on-chips para prever o resultado do impacto de um medicamento em testes clínicos e avaliar as interações do medicamento com os hepatócitos no laboratório.
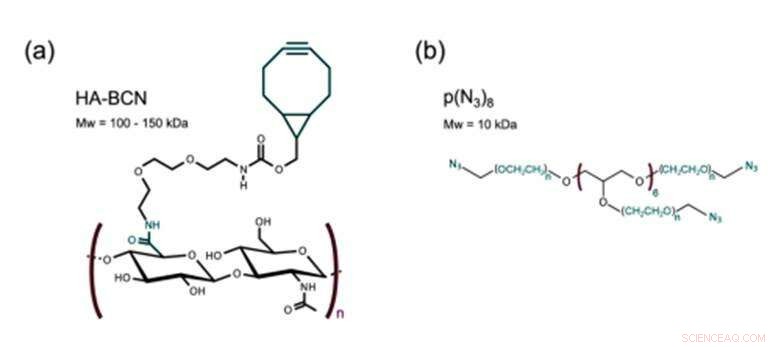
Estrutura de a) HA-BCN com uma razão n / m de 0,19 e b) p (N3) 8. Crédito: Biofabricação , doi:https://doi.org/10.1088/1758-5090/aaf657
Devido à sua ampla adoção em ambientes acadêmicos e industriais, os biorreatores requerem materiais e condições otimizados para fabricação de alto rendimento. As condições incluem a substituição do material de prototipagem comum polidimetilsiloxano (PDMS), integrar células derivadas de células-tronco pluripotentes induzidas (iPSC) em um biomaterial macio que facilita seu crescimento e minimiza o grande volume morto causado por reservatórios microfluídicos e tubos de dispositivos de órgão em chips.
O novo biomaterial preparado no estudo continha dois constituintes principais reticulados via SPAAC; um hialuronano modificado por cicloócito (HA-BCN) e um PEG modificado por azida multiarmed [p (N 3 ) 8 ] O BCN reagiu com azidas (N 3 ) no polímero PEG de 8 braços com terminação N 3 -moieties para formar um 1 estável, 2, 3-triazol. Christoffersson et al. completaram as reações químicas sob condições fisiológicas para formar os hidrogéis com propriedades viscoelásticas ajustáveis. A estratégia de reticulação era ideal para fabricar hidrogéis para cultura de células 3D; já que as células podiam ser encapsuladas no biomaterial sem comprometer sua viabilidade e eram adequadas para uso em dispositivos microfluídicos. Os cientistas usaram o excesso de frações SPAAC no novo biomaterial para anexar diferentes ligantes, incluindo peptídeos RGD, para promover interações na interface célula-material.
Depois disso, os cientistas variaram a composição dos dois principais constituintes para entender as propriedades viscoelásticas resultantes, tais como o módulo de armazenamento (G ') e módulo de perda (G ") dos hidrogéis via reologia oscilatória (técnica para medir o comportamento viscoelástico de materiais moles). Eles controlaram a cinética de gelificação do novo hidrogel em temperaturas crescentes. Cinética de gelificação de o novo biomaterial foi lento o suficiente para a distribuição homogênea de células, mas rápido o suficiente para evitar a sedimentação celular. A capacidade de controlar a cinética de gelificação permitiu que os cientistas considerassem uma variedade de estratégias de biofabricação (por exemplo, bioprinting) e montagem de hidrogel dentro dos sistemas microfluídicos para organ-on- aplicações de chips.
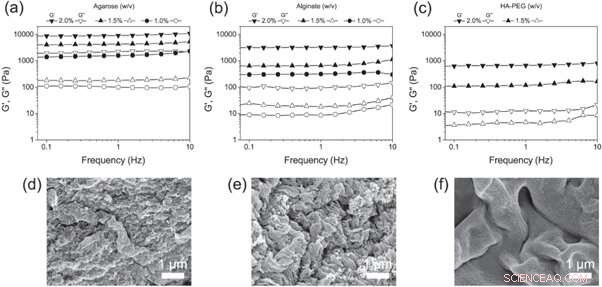
(a) - (c) Varreduras de frequência de (a) agarose, (b) alginato e (c) hidrogéis de HA-PEG em diferentes concentrações. (d) - (f) micrografias SEM de (d) agarose, (e) alginato e (f) hidrogéis HA-PEG mostrando a morfologia de cada hidrogel. Crédito: Biofabricação , doi:https://doi.org/10.1088/1758-5090/aaf657
Christoffersson et al. em seguida, comparou os hidrogéis HA-PEG com as estruturas de cultura de células 3D bem estabelecidas - hidrogéis de agarose e alginato. A fim de determinar as propriedades viscoelásticas finais adequadas para experimentos de cultura de células 3D, eles usaram reologia oscilatória para examinar as diferentes concentrações de polímero. Os cientistas analisaram a composição dos materiais finalizados usando imagens de microscopia eletrônica de varredura (MEV).
O design e a configuração do liver-on-a-chip tiveram que atender a dois critérios principais no estudo:
1. Permitir a perfusão (passagem de fluido) do meio de cultura de células através da superfície do hidrogel para uma troca constante de nutrientes, de e para os hepatócitos encapsulados.
2. Permitir a amostragem da mídia perfundida para análise experimental durante a cultura de células em andamento, sem afetar os hepatócitos e o hidrogel.
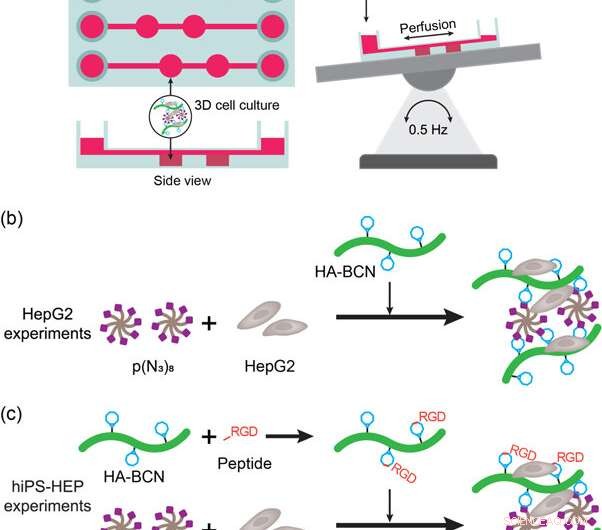
(a) Representação esquemática do dispositivo liver-on-a-chip e configuração. O dispositivo foi colocado em uma mesa oscilante automática para permitir a perfusão de meios e nutrientes durante a cultura de células. (b) Descrição dos experimentos de cultura de células HepG2 3D com hidrogéis de HA-PEG. As células HepG2 foram adicionadas a p (N3) 8 suspenso no meio antes da adição de HA-BCN. (c) Descrição dos experimentos de cultura de células hiPS-HEP 3D com hidrogéis HA-PEG. As células hiPS-HEP foram adicionadas a p (N3) 8 suspenso no meio antes da adição de HA-BCN. Em experimentos usando linRGD ou peptídeo cRGD, o HA-BCN foi pré-incubado com 1 μM do peptídeo correspondente por 1 h antes de adicionar o componente HA-BCN (RGD) à mistura hiPS-HEP / p (N3) 8. Crédito: Biofabricação , doi:https://doi.org/10.1088/1758-5090/aaf657
Para atender a esses critérios, os cientistas usaram um dispositivo comercial de cultura de células 3D (μ-Slide III 3D Perfusion IbiTreat) contendo duas câmaras consecutivas (2 x 30 µL) em três matrizes paralelas - cada uma conectada a reservatórios de mídia para perfundir o líquido. Para uma perfusão eficaz, eles montaram o dispositivo em uma mesa de balanço automática, invertendo a direção do perfusato nas câmaras contendo hidrogel. A configuração experimental permitiu a perfusão através do dispositivo, cumprindo os primeiros critérios. Para cumprir o segundo critério, as paredes localizadas adjacentes às câmaras de hidrogel permitiram aos cientistas amostrar o perfusato sem interferir no hidrogel ou nos constituintes celulares.
Os cientistas investigaram pela primeira vez a biofuncionalização de dispositivos liver-on-a-chip no estudo com células HEPG2 (linha de células de carcinoma do fígado) encapsuladas em hidrogéis, depois das 3, 7 e 9 dias de cultura de células. Eles compararam a morfologia celular, viabilidade e funcionalidade com hidrogéis de agarose e alginato. O estudo incluiu ensaios de vida / morte para confirmar a viabilidade celular e confirmou ainda mais a funcionalidade de HepG2 pela detecção de secreções de albumina e uréia no sobrenadante da cultura de células.
Para melhorar a funcionalidade da célula (fixação de superfície e mobilidade em materiais), os cientistas enxertaram motivos de adesão celular, como peptídeos RGD lineares ou cíclicos (linRGD linear ou cRGD cíclico) nos hidrogéis. Neste caso, As células hiPS-HEP (células-tronco de hepatócitos) foram cultivadas em diferentes composições de hidrogel por 13 dias para examinar a morfologia e a viabilidade (coloração viva / morta) após interações célula-material. Os cientistas usaram seis superfícies diferentes de biomateriais à base de hidrogel nos experimentos, incluindo; 2D (revestimento HEP), Agarose, Alginato, HA-PEG, HA-PEG (linRGD) e HA-PEG (cRGD).
As células hiPS-HEP encapsuladas e cultivadas no hidrogel modificado cresceram em construções 2D e 3D verdadeiras. Para testar a funcionalidade das células cultivadas hiPS-HEP (células-tronco), os cientistas quantificaram sua excreção de albumina e uréia. Os resultados mostraram que apenas os sobrenadantes de células-tronco cultivadas em superfícies 2D e na presença dos hidrogéis com motivo cRGD secretaram albumina.
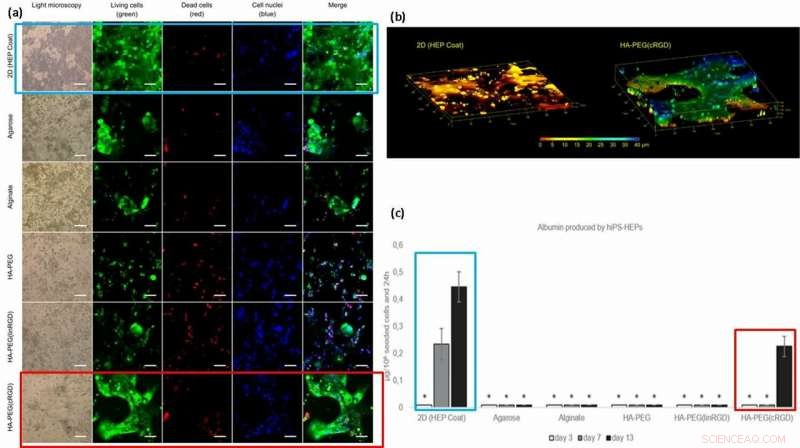
(a) Viabilidade e morfologia de células hiPS-HEP após 13 dias de cultura. A viabilidade celular parece ser dependente da capacidade da célula de se ligar à superfície, o hidrogel, ou entre si. Grandes estruturas de hiPS-HEPs foram formadas em HA-PEG (cRGD). (calceína, verde), células mortas (homodímero de etídio-1, vermelho), e núcleos (Hoechst 33 342, azul). (b) Z-stack de imagens obtidas por microscopia confocal revela a forma plana de hiPS-HEPS quando cultivada em um substrato 2D (esquerda) em comparação com os construtos 3D das células em um hidrogel HA-PEG (cRGD) (direita). As cores representam a altura acima da parte inferior da câmara do dispositivo de cultura de células 3D, ou seja, o eixo Z, de 0 μm (vermelho) a 40 μm (azul). (c) Albumina produzida por hiPS-HEP no revestimento HEP em 2D e nos diferentes hidrogéis. * indica que os níveis de concentração de albumina eram muito baixos para uma quantificação confiável. Crédito: Biofabricação , doi:https://doi.org/10.1088/1758-5090/aaf657
Com base nos resultados, os cientistas atribuíram a maior quantidade de albumina no revestimento HEP 2D à taxa de difusão da albumina dentro dos hidrogéis; transferência através do revestimento 2D sendo mais rápida do que 3D. A maior concentração de albumina com hidrogéis ligados ao motivo cRGD, correlacionado com o aumento do crescimento celular e viabilidade observada nas superfícies de biomateriais ligados a cRGD. Como resultado, os cientistas pretendem usar formas cíclicas de peptídeo RGD para auxiliar a cultura de células-tronco de hepatócitos em hidrogéis preparados para dispositivos de fígado em um chip no futuro.
Desta maneira, o estudo detalhou as vantagens do uso de hidrogel à base de hialuronano-PEG modificado com peptídeos RGD para culturas 3D de hepatócitos (aproximadamente 13 dias) em uma configuração de liver-on-a-chip. Como referência do estudo, Christofferfsson e colegas de trabalho usaram os hidrogéis de alginato e agarose comumente disponíveis. No futuro, os cientistas irão otimizar as propriedades viscoelásticas e a concentração de motivos de adesão celular no sistema de hidrogel HA-PEG para citocompatibilidade biomimética. O sistema de hidrogel otimizado pode ser combinado com a configuração do dispositivo para facilitar plataformas liver-on-a-chip fisiologicamente relevantes para pesquisas clínicas em toxicologia de drogas, descoberta de drogas e medicina regenerativa.
© 2019 Science X Network