
Um único cristal de gelo foi visualizado simultaneamente por microscopia de campo claro (esquerda) e interferometria de Mach-Zehnder (direita) para observar sua morfologia e taxas de crescimento, respectivamente. Crédito:Bayer-Giraldi M. et al., Proceedings of National Academy of Sciences , 2 de julho, 2018
Os cientistas descobriram que uma proteína de ligação ao gelo (fcIBP) da microalga do gelo marinho não se encaixa na classificação convencional de proteínas de ligação ao gelo, sugerindo mecanismos desconhecidos por trás de sua propriedade anticongelante. Essa descoberta pode levar a uma aplicação mais ampla da proteína anticongelante nas indústrias alimentícia e médica.
Os organismos que vivem em zonas frias produzem proteínas de ligação ao gelo (anticongelantes) para evitar o congelamento até a morte. Essas proteínas foram classificadas em dois grupos; o tipo hiperativo se liga às faces basais hexagonais dos cristais de gelo para inibir o crescimento de cristais de gelo e reduz a temperatura de congelamento em até seis graus C, enquanto o tipo moderado não se liga às faces basais e reduz a temperatura de congelamento em não mais de 1 grau C.
"Muitos estudos sobre proteínas de ligação ao gelo se centraram em perspectivas bioquímicas, mas essas proteínas só recentemente foram pesquisadas do ponto de vista da física de crescimento de cristal, "diz o professor Gen Sazaki da equipe de pesquisa da Universidade de Hokkaido.
Os pesquisadores usaram sua câmara original, desenvolvido no Instituto de Ciência de Baixa Temperatura da Universidade de Hokkaido, que lhes permitiu observar em detalhes o crescimento de cristais de gelo na água. A morfologia dos cristais de gelo aos quais fclBP se ligou foi observada em microscópios e suas taxas de crescimento foram medidas com precisão.
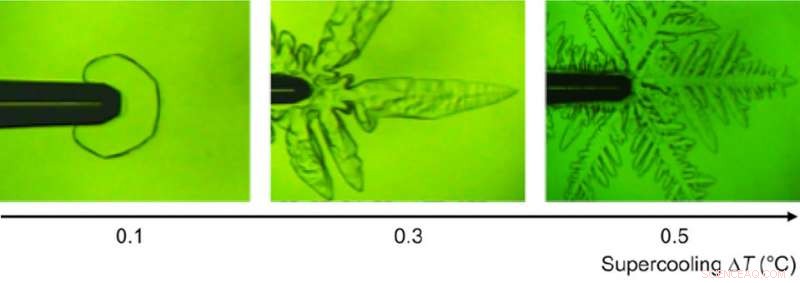
Cristais únicos de gelo em diferentes temperaturas de super-resfriamento observadas sob um microscópio. Crédito:Bayer-Giraldi M. et al., Proceedings of National Academy of Sciences , 2 de julho, 2018
"Para nossa surpresa, descobrimos que fclBP - que é conhecido por ser eficaz na redução do ponto de congelamento em menos de 1 grau C - se liga às faces basal e prisma, afetando assim o crescimento do cristal de gelo, "diz a Dra. Maddalena Bayer-Giraldi, primeiro autor do Alfred-Wegener-Institute, Centro Helmholtz de Pesquisa Polar e Marinha (AWI). Quando a temperatura da água não estava muito baixa, o crescimento do cristal foi inibido e os cristais de gelo tornaram-se facetados, aparecendo como placas hexagonais, um fenômeno nunca visto em cristais de gelo em água pura. Quando a temperatura da água estava suficientemente baixa, os cristais de gelo assumiram a forma dendrítica normal. Mas, como o fclBP suprimiu o crescimento do cristal de gelo nas faces do prisma, os ramos dendríticos tornaram-se mais estreitos, permitindo a liberação mais fácil do calor e, assim, o crescimento mais rápido das pontas dos ramos do cristal.
O estudo mostrou que o fclBP se liga às faces basal e prismática dos cristais de gelo, embora seja capaz de diminuir o ponto de congelamento em menos de 1 grau C ou mais, desafiando a classificação convencional de proteínas de ligação ao gelo. "As funções das proteínas de ligação ao gelo não podem ser avaliadas apenas pela ligação das proteínas às faces basais ou pela inibição do crescimento dos cristais de gelo. Precisamos entender os mecanismos moleculares por trás de suas propriedades anticongelantes. Uma maior compreensão das proteínas de ligação ao gelo pode levar à sua aplicação na preservação de alimentos e órgãos vivos, bem como na criocirurgia, "diz a Dra. Maddalena Bayer-Giraldi.