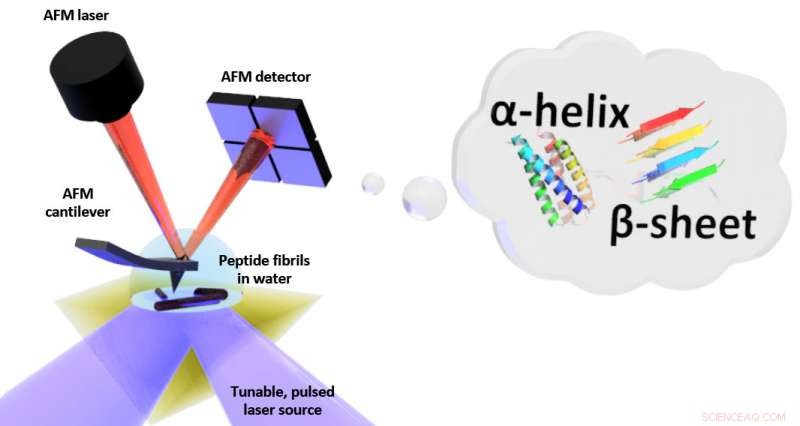
Esquema da configuração para ressonância induzida fototérmica (PTIR), que inclui uma fonte de laser infravermelho e um cantilever de microscópio de força atômica (AFM) com uma ponta afiada que toca a amostra e vibra em resposta à expansão induzida pela luz da amostra. PTIR pode determinar o padrão de dobramento (chamado, por exemplo, α-hélice, folha β) de peptídeos (cadeias de aminoácidos) em água com resolução em escala nanométrica. Crédito:NIST
Mexer com um método que ajudaram a desenvolver nos últimos anos, os cientistas mediram pela primeira vez em escala nanométrica os padrões característicos de dobras que dão às proteínas sua forma tridimensional na água. Desenvolvido por pesquisadores do Instituto Nacional de Padrões e Tecnologia (NIST) e seus colegas, esta técnica ajudará os cientistas a obter conhecimentos sobre o comportamento das biomoléculas em ambientes aquosos semelhantes aos das células. Essas percepções, por sua vez, poderia aumentar nossa compreensão das principais doenças, incluindo Alzheimer, que estão relacionados a "erros" no enovelamento de proteínas.
A vida como a conhecemos não poderia sobreviver se as proteínas não se dobrassem em padrões precisos levando a hélices, folhas e outras formas que dão às proteínas sua estrutura tridimensional. As formas precisas das proteínas permitem que transportem oxigênio, afastar bactérias nocivas e realizar outras tarefas essenciais no corpo. Proteínas que se dobram inadequadamente não podem funcionar e às vezes geram fragmentos tóxicos, como aqueles associados a doenças neurodegenerativas.
Para entender os meandros da dobra, os cientistas precisam estudar o arranjo detalhado das cadeias de aminoácidos que são mais curtas e mais simples do que as proteínas - chamadas de peptídeos - e como elas se dobram, montar e girar para criar uma variedade de formas, ou conformações. Os biólogos preferem examinar proteínas e peptídeos imersos em água porque esse ambiente se aproxima muito das condições dentro das células vivas.
Técnicas previamente estabelecidas para determinar a conformação de proteínas, como espectroscopia infravermelha, falta a resolução espacial precisa para estudar os conjuntos minúsculos e diversos de proteínas devidamente dobradas e mal dobradas. Além disso, essas técnicas não funcionam bem em um ambiente aquoso porque a água absorve fortemente a luz infravermelha, confundindo a análise. A água também representou sérios desafios para uma técnica pioneira, conhecido como ressonância induzida fototérmica (PTIR), que recentemente permitiu aos pesquisadores examinar a estrutura e conformação do peptídeo no ar com resolução em nanoescala.
Os pesquisadores do NIST e seus colegas demonstraram agora que o PTIR pode ser adaptado para obter a estrutura conformacional em nanoescala em água usando dois peptídeos quimicamente semelhantes, conhecidos como difenilalanina e Boc-difenilalanina. A difenilalanina está relacionada ao beta-amiloide, um pegajoso, peptídeo maior ligado à doença de Alzheimer.
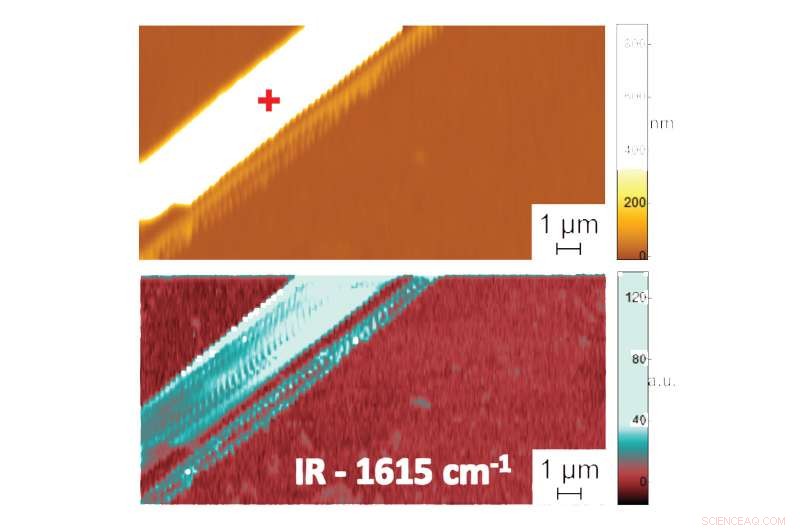
Aparece em:A forma na água:primeiras medições em escala nanométrica da estrutura dobrada de biomoléculas em líquidos. Imagem de microscópio de força atômica mostrando topografia (topo) e imagem de absorção PTIR indicando composição e conformação (embaixo) de uma fibrila de peptídeo difenilalanina em água. Dados adicionais, registrar o espectro da radiação infravermelha absorvida pelas fibrilas de peptídeo, fornece informações sobre seu padrão de dobra. O espectro PTIR indicado, por exemplo, que a difenilalanina assume uma conformação de folha β anti-paralela pura. Crédito:NIST
“PTIR é uma técnica poderosa que já se mostrou promissora para o estudo de sistemas biológicos, mas a possibilidade de usar isso com amostras em um ambiente líquido irá melhorar muito seu uso nesta área, "disse Georg Ramer do NIST e da Universidade de Maryland em College Park. Ramer e a pesquisadora do NIST Andrea Centrone, junto com seus colegas da Universidade de Cambridge, na Inglaterra, descreveu seu trabalho em um artigo recentemente postado online em ACS Nano .
O PTIR determina a composição química dos materiais com resolução em nanoescala combinando um microscópio de força atômica (AFM) com a luz de um laser infravermelho que opera em uma faixa de comprimentos de onda. Os comprimentos de onda característicos da luz infravermelha que são absorvidos pela amostra são semelhantes a uma impressão digital molecular, revelando sua composição química. Em cada local da amostra onde o infravermelho é absorvido, o material esquenta, fazendo com que rapidamente, mas muito ligeiramente, expandir. A expansão é detectada, com a ponta afiada do AFM projetando-se de um cantilever, que oscila como um trampolim cada vez que a amostra se expande. Quanto mais luz é absorvida pela amostra, quanto maior sua expansão e maior a força, ou amplitude, das oscilações.
Tão bom quanto o PTIR é, usar o método em um ambiente aquático é problemático. A água absorve fortemente a luz infravermelha, produzindo um sinal de absorção que pode interferir nos esforços para discernir a estrutura química da amostra. Além disso, a força de arrasto exercida pela água é muito mais forte do que no ar e normalmente enfraquece o sinal PTIR, pois amortece fortemente as oscilações do cantilever do AFM.
Para limitar a absorção da luz infravermelha pela água, a equipe colocou um prisma entre o laser e a amostra. O prisma serviu para confinar a luz infravermelha à superfície da amostra, minimizando a quantidade que poderia vazar e interagir com a água. Para resolver o problema de amortecimento, a equipe usou um laser que pode operar em frequências de até 2, 000 quilohertz. Isso permitiu aos pesquisadores combinar a frequência dos pulsos de laser com uma das frequências mais altas em que o cantilever oscila. Como empurrar uma criança em um balanço no intervalo certo, o casamento de frequência aumentou a amplitude das oscilações do cantilever, compensando parcialmente o amortecimento devido à água.
Para demonstrar a precisão de seu método, a equipe comparou medições PTIR de difenilalanina e outras amostras de peptídeos em dois ambientes:água e ar. (Os peptídeos dobraram de forma semelhante em ambos os meios, tornando mais fácil realizar a comparação.) Notavelmente, os cientistas alcançaram resolução espacial semelhante e contraste na água e no ar, demonstrando pela primeira vez que as medições em um ambiente aquático podem ser realizadas com precisão, revelando a conformação precisa de peptídeos com resolução em nanoescala.
"Esta descoberta é importante para os biólogos que desejam compreender a estrutura e o enovelamento das proteínas em ambientes tão próximos quanto possível daqueles nas células, "disse Centrone.