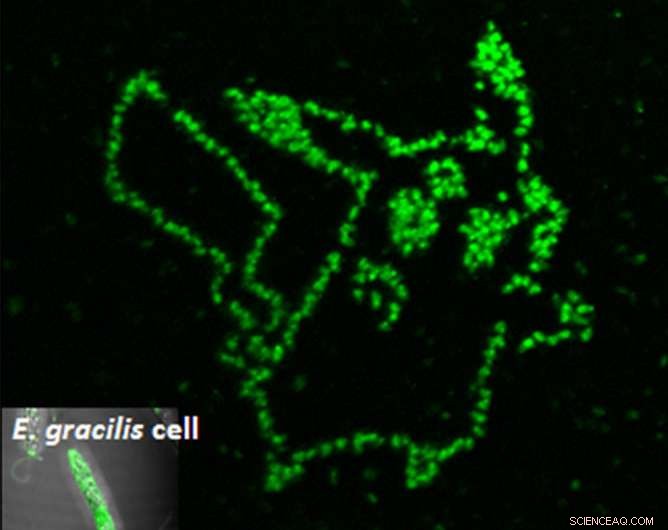
A fotoporação de um aptâmero fluorogênico em células de microalgas individuais mostra exatamente onde o metabólito desejado está localizado. Crédito:Yoichiroh Hosokawa
Na busca por novas fontes de consumíveis, os cientistas perceberam que a própria vida pode ser a solução. Os engenheiros metabólicos alteraram o metabolismo dos organismos vivos para fazer novas drogas, biodegradáveis e biocombustíveis. Um dos melhores exemplos dos tempos modernos é a penicilina. As bactérias da engenharia metabólica melhoraram a taxa de produção desta droga mais de 100 vezes.
Um grande desafio neste campo é identificar quais células são mais produtivas. É relativamente fácil estudar populações em massa, que resulta em informações sobre o metabolismo da população total de células. Contudo, permanece extremamente difícil identificar quais células na população em massa estão acima do resto em termos de produção de metabólitos e são, portanto, as melhores para copiar e imitar. Essa identificação requer a observação dos processos internos de células individuais em tempo real enquanto o metabólito é produzido. Cientistas do Instituto de Ciência e Tecnologia de Nara (NAIST) relatam um novo sistema que atinge esse objetivo em células de microalgas. O sistema combina aptâmeros fluorogênicos com fotoporação a laser de femtosegundo. O estudo é publicado em Relatórios Científicos .
"As algas têm uma série de qualidades atraentes para a engenharia metabólica. Primeiro, eles são extremamente adaptáveis, já que eles têm a capacidade de viver em uma ampla variedade de ambientes, do equador aos pólos e mesmo em águas altamente salinas ou poluídas, "diz o professor Yoichiroh Hosokawa, quem conduziu o estudo.
Normalmente, os cientistas usam microscopia de fluorescência para olhar dentro de uma célula. Essa estratégia envolve anexar uma molécula que produz fluorescência no metabólito de interesse. Contudo, por causa da proteção da parede celular, tem sido difícil introduzir moléculas fluorescentes que detectam metabólitos específicos em células de microalgas de fora.
A equipe de Hosokawa tem, portanto, desenvolvido aptâmeros fluorescentes que emitem fluorescência ao se ligar ao metabólito paramylon e métodos de fabricação que podem introduzi-los na célula por pulsos de laser.
"Nós sintetizamos um peptídeo de ligação de aptâmero ao paramylon, e o introduziu nas células de Euglena gracilis por processamento a laser de célula única, "disse o Dr. Takanori Maeno, quem foi o primeiro autor do estudo. "Paramylon é produzido apenas por Euglena e funciona como fibra. Pode ser refinado em biocombustíveis, " ele adicionou.
Para obter o aptâmero dentro da célula, os cientistas dispararam nas células com pulsos de laser de apenas femtossegundos. Esses pulsos criaram poros temporários grandes o suficiente para os aptâmeros entrarem. Uma vez dentro, as células ficavam verdes apenas em lugares onde os aptâmeros se ligavam ao paramilone. Usando esta técnica, O grupo de Hosokawa conseguiu medir o acúmulo de paramilones com o tempo, discriminando assim células eficientes de seus vizinhos improdutivos.
Embora o sistema tenha sido testado apenas em paramilones, Hosokawa afirma que outros metabólitos serão detectáveis com aptâmeros apropriados.
"Nosso método fornece informações espaciais e temporais sobre o paramilone intracelular alvo, mas deve funcionar para qualquer tipo de metabólitos no futuro. Será útil para selecionar células de alto desempenho, " ele disse.